Sila ozónu, jeho vzťah k rozvoju reči a oblasti skladovania. Kontrola ozónu vo vode Kontrola ozónu vo vode
OZONE (O 3) je alotropická modifikácia kyslosti, molekula je zložená z troch atómov do farby a pravdepodobne zo všetkých troch agregátnych mlynov. Molekulový ozón má štruktúru vo forme ryon-femorálnej trojkolky s vrcholom 127 o. Uzavretá trojkolka sa však neujme, ale molekula konope lantyuga má 3 atómy vo forme 0,224 nm. V závislosti od molekulárnej štruktúry je dipólový moment skladu 0,55 debye. V elektronickej štruktúre sú molekuly ozónu očíslované 18 elektrónmi, ktoré predstavujú mezomérne stabilný systém, ktorý sa používa v iných krajinách blízko Cordonu. Prikordonnyho iónové štruktúry predstavujú dipólový charakter molekuly ozónu a vysvetľujú jej špecifické reakčné správanie v kyslom stave, čo je radikál s dvoma nepárovými elektrónmi. Molekula ozónu sa skladá z troch atómov. Chemický vzorec pre plyn -O 3 Reakcia na ozón: 3O 2 + 68 kcal / mol (285 kJ / mol) ⇄ 2O 3 Molekulová hmotnosť na ozón - 48 At izbová teplota ozón je neobchodovateľný plyn s charakteristickým zápachom. Vôňa ozónu je vnímaná v koncentrácii 10 -7 M. V rodnej krajine je ozón tmavomodrou farbou s teplotou topenia -192,50 C. Tuhý ozón je kryštál čiernej farby s teplotou -111,9 stupňov C. Pri teplote 0 gr. a 1 atm. = 101,3 kPa, koncentrácia ozónu sa stane 2,143 g / l. V plynovom mlyne je ozón diamagnetický a vyfukuje z magnetického poľa, v plynovom mlyne je slabo paramagnetický, takže je volodynový. magnetické pole a byť vtiahnutý do magnetického poľa.
Chémia pre ozón
Molekula ozónu je neprchavá a pri dostatočných koncentráciách sa v prípade normálnej mysle transformuje na teplom rozsievkový kyslík. Úprava teploty a zníženie tlaku na zvýšenie účinnosti distribúcie ozónu. Kontaktujte ozón s malými množstvami organické reči, Deyakikhské kovy alebo oxidy rýchlo urýchlia transformáciu. Chemická aktivita ozónu je ešte väčšia, ale je to silné oxidačné činidlo. Všetky kovy boli oxidované a všetky boli kovové (za vínatkom zo zlata, platiny a irídia) a veľa nekovov. Produktom reakcie je hlavne bozk. Ozón nájdete vo vode farebnejšie, menej ružovo, žiadne záludné riešenie, navyše rýchlosť jeho distribúcie v rozmedzí 5-8 krát v potravinách, nie v plynnej fáze, nie v plynnej fáze (Rozumovskiy SD, 1990 ). Cena evidentne nie je spôsobená špecifickosťou kondenzovanej fázy, ale reakciami s domami a iónom hydroxylu; Rozdiel medzi ozónom a chloridom sodným je v súlade s Henryho zákonom. So zvýšením koncentrácie NaCl pri uvoľňovaní vody sa rýchlosť uvoľňovania ozónu znižuje (Tarunina V.N. a spіvavt., 1983). Ozón je ešte menej konkurencieschopný až do elektrónu (1,9 eV), čo je silné oxidačné činidlo, ktoré je lepšie ako fluór (Rozumovskiy S.D., 1990).Biologická sila ozónu a jeho infúzia v ľudskom tele
Visoka oxidujúca budova a tí, ktorí sú v chemických reakciách bagatokhu, ktoré tlačia na účasť ozónu, predstierajú, že sú kyslé radikály, obmedzujú celý plyn na okraji, nie sú pre ľudí bezpečné. Jakov plynový ozón vstreknutý do lyudínu:- Dratu a poshkozhu tkaniny organіv dikhannya;
- Nalievanie cholesterolu do krvi ľudskej bytosti, vnímanie nervových foriem, čo vedie k ateroskleróze;
- Dovge znakhozhennya v strede so zvýšenou koncentráciou ozónu môže byť dôvodom cholovic bezpliddya.
- Maximálna jednorazová hraničná prípustná koncentrácia (GDK m.r.) v atmosférické jedlo populácia m_sc 0,16 mg / m 3
- Stredne prípustná hraničná koncentrácia (GDK d.s.) - 0,03 mg / m 3
- Hraničná prípustná koncentrácia (HDC) v druhej pracovnej zóne je 0,1 mg / m 3 (súčasne sa čas ľudskej vône blíži 0,01 mg / m 3).
Vysoký a nízky výkon pre ozón
Ozón je prítomný v dvoch sférach atmosféry. Troposférický alebo prízemný ozón, ktorý sa nachádza v najbližšej sfére atmosféry k povrchu Zeme, nie je v troposfére bezpečný. Vyhrajte shkidliviy pre ľudí a ďalšie živé organizmy. Víno vrhá zuby na stromy, aby pestovalo hodvábne rozmanité kultúry. Okrem toho je troposférický ozón jedným z popredných „prísad“. V rovnakú hodinu je stratosférický ozón dokonca škorica. Ruynuvannya ním nastavil ozónovú guľu (ozónovú clonu) na výrobu skôr, ako narastie tok ultrafialového viprominuvannya na zemský povrch. Prostredníctvom nárastu počtu chorôb spôsobených rakovinou shkiri (vrátane najnebezpečnejšieho typu melanómu), infekcií katarakty. Injekcia tvrdého ultrafialového žiarenia oslabuje imunitu. Prevažná expozícia UV žiareniu môže byť tiež problémom Silskoy vláda Ako teda môžete urobiť svoje plodiny tak citlivé na ultrafialové žiarenie. V rovnakú hodinu sa spomalila pamäť, scho ozón je odpadový plyn, a pri rivne zemský povrch vyhrať є budeme usilovní. Ovplyvnený intenzívnou ospalou viprominuvannyou a špecifikáciami v každom kroku predstiera, že je obzvlášť bohatý na sladký ozón.Vzaєmodiya ozón a kyslý jeden po druhom. Podrobnosti a detaily.
Ozón je alotropická forma kyseliny. Allotropia je prejavom toho istého chemického prvku v dvoch alebo viacerých jednoduchých slovách. V tomto prípade sú schválené ozón (O3) a kyslík (O 2) drzý prvok O. Otrimannya na ozón z kyslosti Na vyradenie ozónu sa spravidla používa molekulárny kyslík (O 2) a samotný proces je opísaný zvyčajným 3O 2 → 2O 3. Reakcia je endotermická a ľahko reverzibilná. Zadajte substitúciu rovnováhy v celom produkte (ozóne). Jednou z možností eliminácie ozónu je použitie oblúkového výboja. Tepelná disociácia molekúl so zvyšujúcou sa teplotou. Takže pri T = 3000 K - zm_st atómovej kyslosti sa stáva ~ 10%. Teplotu v niekoľko tisíc stupňoch je možné nastaviť na ďalší oblúkový výboj. Pri vysokých teplotách sa však ozón vyvíja rýchlejšie ako molekulárna kyslosť. Je možné sa ho zbaviť, je možné ho zmeniť, ohriať plyn a potom ho rýchlo ochladiť. Ozón v tejto forme je medziproduktom pri prechode zo súčtu O 2 + O na molekulárnu kyselinu. Maximálna koncentrácia O 3, yaku je možné orezať týmto spôsobom výroby, dosah je 1%. Celkom dosť na mnohé priemyselné účely. Oxidačná sila na ozón Ozón je tvrdo lisované oxidačné činidlo, ktoré je reaktívnejšie v poréznej kyseline. Oxidácia všetkých kovov a bohato nekovov podľa schválenia kyslosti: 2 Cu 2+ (aq) + 2 H 3 O + (aq) + O 3 (g) → 2 Cu 3+ (aq) + 3 H 2 O (1) + O 2 (g) Ozón môže hrať úlohu v reakciách pece, teplota pece pri celej teplote, nižšia pri teplote v atmosfére kyseliny rozsievkovej: 3 C 4 N 2 + 4 O 3 → 12 CO + 3 N 2 Štandardný potenciál ozónu je 2,07 V, Na to sa molekula ozónu nemení a transformuje sa na teplo vo forme tepla. Pri nízkych koncentráciách sa ozón vyvíja častejšie, pri vysokých koncentráciách - s vibuchom má teda molekula nadbytočnú energiu. Zahrievanie a kontaktovanie ozónu s malými časticami organických kvapalín (hydroxid, peroxid, kov s nízkou valenciou a ďalšie oxidy) rýchlo urýchľuje transformáciu. Navpaks, prítomnosť malých množstiev kyseliny dusičnej a stabilizuje ozón, a v nádobách zo skladu a niektorých plastov alebo čistých kovov ozón pri -78 0 ° C je prakticky rozvinutý. Konkurencieschopnosť ozónu voči elektronickým dverám 2 ev. Spóra volodínu je taká silná, že iba fluór a tento oxid. Ozón oxidoval všetky kovy (za vinetou zlata a platiny), ako aj veľké množstvo ďalších prvkov. Chlór sa stará o časť reakcií s ozónom a chlórnanom ОCL. Reakcie na ozón s atómovou vodou z dzherel za vzniku hydroxylových radikálov. Ozón má maximálny obsah vlhkosti v UV oblasti pri zvýšení o 253,7 nm s molárnym koeficientom vyhynutia: E = 2900 Pri danej UV-fotometrickej hodnote koncentrácie ozónu súčasne s jódovo-metrickou titráciou prijatého štandardy. Kisen, na základe ozónu, nevstupuje do reakcie s KI.Stabilita ozónu a vody
Likvidita distribúcie ozónu v rozmedzí 5-8 krát v potravinách, nižšia v plynnej fáze. Rozklad ozónu vo vode je 10 -krát vyšší, nižšia kyslosť. Podľa údajov predchádzajúcich autorov sa hodnota účinnosti ozónu vo vode pohybuje od 0,49 do 0,64 ml ozónu / ml vody. V ideálnych termodynamických mysliach je potrebné dodržať Henryho zákon, aby koncentrácia rozbitého plynu bola úmerná jeho čiastočnému zlozvyku. C S = B × d × Рi de: С S - koncentrácia bujónu vo vode; d - hmotnostný ozón; Pi - čiastočné uchopenie ozónu; B - účinnosť výpočtu; Stanovenie Genriho zákona pre ozón ako metastabilný plyn je múdre. Pokles ozónu v plynnej fáze spočíva v čiastočnom zveráku. Vo vodnom centre existujú niektoré procesy, ktoré presahujú oblasť zákona Genri. Gibs-Dukem-Margulesdu zákon nahradí nový v ideálnych mysliach. Prakticky sa akceptuje striedanie rozdielu ozónu vo vode prostredníctvom zníženia koncentrácie ozónu v strednej pôde na koncentráciu ozónu v plynnej fáze: Pri rovnakých umývadlách vo vode z vodovodu sa koncentrácia ozónu stáva 13 mg / l, v dvakrát destilovanej vode - 20 mg / l. Dôvodom je výrazný pokles ozónu v zimných domoch v blízkosti pitnej vody.Pokles ozónu a obdobia v priebehu іvіrozpadu (t 1/2)
Vo vodnom centre ozón výrazne klesá, pokiaľ ide o kvalitu vody, teplotu a pH stredu. Zvýšenie pH strednej pôdy urýchli pokles ozónu a zníži koncentráciu ozónu vo vode. Analogické procesy prebiehajú pri nastaviteľnej teplote. Obdobie poklesu ozónu v destilovanej vode trvá 10 rokov, v demineralizovanej vode - 80 chilínov; v destilovanej vode - 120 chilínov. Distribúcia ozónu vo vode є skladacím procesom reakcií radikálnych kyselín: Maximálne množstvo ozónu vo vodnom oku je zabránené konzumácii 8-15 minút. Po 1 roku sa v poradí objaví iba niekoľko radikálov. Našli sme medzi nimi hydroxylový radikál (OH ') (Staehelin G., 1985) a je potrebné rešpektovať úpravu ozónovej vody na terapeutické účely. Oscilácie v klinickej praxi, aby sme poznali množstvo ozonizovanej vody a ozonované fyziologické zmeny, sme vykonali hodnotenie množstva ozonovane v množstve ozónu v koncentrácii, ako je to v prevalencii vitamínov v medicíne. Hlavnými analytickými metódami boli jodometrická titrácia a intenzita chemiluminiscencie z mikroobvodu pripojeného k biochemiluminometru BKhL-06 (Nižnij Novgorod) (Kontorshchikova K.N., Peretyaginov S.P., 1995). Fenomén chemiluminiscencie je spojený s reakciami rekombinácie klzných radikálov, ktoré vznikajú pri umiestnení ozónu do vody. Pri vzorkovaní 500 ml dvakrát destilovanej vody a prebublávajúceho ozónovo-kyslého plynu s koncentráciou ozónu v rozmedzí 1 000-1 500 mcg / l a rýchlym prietokom plynu 1 l / h na úseku 20 čilín, chemiluminiscencia vyvii 160 Navyše v dvakrát destilovanej vode je intenzita svetla čisto, ale nie v destilovanej vode. Tolerancia ozónu v pomeroch NaCl je v súlade s Henryho zákonom, aby sa znížila v dôsledku zvýšenia koncentrácie soli. Psychologické poruchy boli poliate ozónom s koncentráciou 400, 800 a 1 000 μg / l s úsekom 15 chilínov. Globálna intenzita svetla (v mv) sa zvýšila v dôsledku rastúcej koncentrácie ozónu. Trivialita svitinnya sa stáva 20 hilínmi. Cena je vysvetlená rozsiahlou rekombináciou silných radikálov a výsledkami zhasnutia svetla pre prejav fyziologického vývoja domov. Bez ohľadu na vysoký oxidačný potenciál je ozón vysoko selektívny, pretože je nabitý polárnymi budickými molekulami. Mierne reagujte s ozónom na polhodinovom základe, aby ste mohli nahradiť jemný zvuk (-C = C-). Výsledkom je, že citlivé na ozón-nenasýtené mastné kyseliny, aromatické aminokyseliny a peptidy, sú ostriežované pre všetky skupiny SH. Vyplýva to z údajov Kregeho (1953) (cit. Vieban R. 1994), prvého produktu interakcie molekúl ozónu s biologickými substrátmi - 1-3 dipolárnych molekúl. Reakcia je hlavná v interakcii ozónu s organickými substrátmi pri pH< 7,4.
Озонолиз проходит в доли секунды. В растворах скорость этой реакции равна 105 г/моль·с. В первом акте реакции образуется пи-комплекс олефинов с озоном. Он относительно стабилен при температуре 140 0 С и затем превращается в первичный озонид (молозонид) 1,2,3-триоксалан. Другое возможное направление реакции — образование эпоксидных соединений.
Первичный озонид нестабилен и распадается с образованием карбоксильного соединения и карбонилоксида. В результате взаимодействия карбонилоксида с карбонильным соединением образуется биполярный ион, который затем превращается во вторичный озонид 1,2,3 — триоксалан. Последний при восстановлении распадается с образованием смеси 2-х карбонильных соединений, с дальнейшим образованием пероксида (I) и озонида (II).
Maximálne množstvo ozónu vo vodnom oku je zabránené konzumácii 8-15 minút. Po 1 roku sa v poradí objaví iba niekoľko radikálov. Našli sme medzi nimi hydroxylový radikál (OH ') (Staehelin G., 1985) a je potrebné rešpektovať úpravu ozónovej vody na terapeutické účely. Oscilácie v klinickej praxi, aby sme poznali množstvo ozonizovanej vody a ozonované fyziologické zmeny, sme vykonali hodnotenie množstva ozonovane v množstve ozónu v koncentrácii, ako je to v prevalencii vitamínov v medicíne. Hlavnými analytickými metódami boli jodometrická titrácia a intenzita chemiluminiscencie z mikroobvodu pripojeného k biochemiluminometru BKhL-06 (Nižnij Novgorod) (Kontorshchikova K.N., Peretyaginov S.P., 1995). Fenomén chemiluminiscencie je spojený s reakciami rekombinácie klzných radikálov, ktoré vznikajú pri umiestnení ozónu do vody. Pri vzorkovaní 500 ml dvakrát destilovanej vody a prebublávajúceho ozónovo-kyslého plynu s koncentráciou ozónu v rozmedzí 1 000-1 500 mcg / l a rýchlym prietokom plynu 1 l / h na úseku 20 čilín, chemiluminiscencia vyvii 160 Navyše v dvakrát destilovanej vode je intenzita svetla čisto, ale nie v destilovanej vode. Tolerancia ozónu v pomeroch NaCl je v súlade s Henryho zákonom, aby sa znížila v dôsledku zvýšenia koncentrácie soli. Psychologické poruchy boli poliate ozónom s koncentráciou 400, 800 a 1 000 μg / l s úsekom 15 chilínov. Globálna intenzita svetla (v mv) sa zvýšila v dôsledku rastúcej koncentrácie ozónu. Trivialita svitinnya sa stáva 20 hilínmi. Cena je vysvetlená rozsiahlou rekombináciou silných radikálov a výsledkami zhasnutia svetla pre prejav fyziologického vývoja domov. Bez ohľadu na vysoký oxidačný potenciál je ozón vysoko selektívny, pretože je nabitý polárnymi budickými molekulami. Mierne reagujte s ozónom na polhodinovom základe, aby ste mohli nahradiť jemný zvuk (-C = C-). Výsledkom je, že citlivé na ozón-nenasýtené mastné kyseliny, aromatické aminokyseliny a peptidy, sú ostriežované pre všetky skupiny SH. Vyplýva to z údajov Kregeho (1953) (cit. Vieban R. 1994), prvého produktu interakcie molekúl ozónu s biologickými substrátmi - 1-3 dipolárnych molekúl. Reakcia je hlavná v interakcii ozónu s organickými substrátmi pri pH< 7,4.
Озонолиз проходит в доли секунды. В растворах скорость этой реакции равна 105 г/моль·с. В первом акте реакции образуется пи-комплекс олефинов с озоном. Он относительно стабилен при температуре 140 0 С и затем превращается в первичный озонид (молозонид) 1,2,3-триоксалан. Другое возможное направление реакции — образование эпоксидных соединений.
Первичный озонид нестабилен и распадается с образованием карбоксильного соединения и карбонилоксида. В результате взаимодействия карбонилоксида с карбонильным соединением образуется биполярный ион, который затем превращается во вторичный озонид 1,2,3 — триоксалан. Последний при восстановлении распадается с образованием смеси 2-х карбонильных соединений, с дальнейшим образованием пероксида (I) и озонида (II).
 Ozonizácia aromatických spolu proti tvrdeniam polymérnych ozonidov. Aplikácia ozónu vyčerpá aromatickú energiu v jadre a energiu vitrátu, a preto je účinnosť homológov ozónu hlavným dôvodom výroby energie. Ozonuvannya sušených v uhľohydrátoch je viazaná na mechanizmus vprovadzhennya. Organická zmes ozonuvannya siro a dusíka sa zmieša nasledujúcim spôsobom:
Ozonizácia aromatických spolu proti tvrdeniam polymérnych ozonidov. Aplikácia ozónu vyčerpá aromatickú energiu v jadre a energiu vitrátu, a preto je účinnosť homológov ozónu hlavným dôvodom výroby energie. Ozonuvannya sušených v uhľohydrátoch je viazaná na mechanizmus vprovadzhennya. Organická zmes ozonuvannya siro a dusíka sa zmieša nasledujúcim spôsobom:  Ozonіdi zazvychay škaredé razchinyayutsya pri vode, bohužiaľ, v organických razchinniki. Pri zahrievaní niektoré z prechodných kovov padajú na radikály. Počet ozonidov v organickej forme je jódové číslo. Jódové číslo - hmotnosť jódu v gramoch, ktorá bola pridaná do 100 g organickej reči. Pre mastné kyseliny by jódové číslo nemalo byť 100-400, pre tuhé tuky 35-85, pre tvrdé tuky-150-200. Vpred ozón, ako prvé antiseptikum A. Wolff v roku 1915, prvý krát dňa. Blížiaci sa osud postupne zhromažďoval informácie o úspechu spotreby ozónu v prípade nezákonných chorôb. Vivoristi však boli triviálnu hodinu zbavení metódy ozonoterapie spojenej s priamymi kontaktmi s ozónom z prstencových plôch a tenkých prázdnych priestorov. Mám záujem o terapiu ozónom, keď som vo svete videl akumuláciu údajov o biologickom účinku ozónu na telo, a budete mať možnosť počuť o úspechu testovania ozónu v prípade celého radu chorôb. História zdravotnícky materiál ozón sa opravuje od 19. storočia. Priekopníci klasických dodávok ozónu v Západnej Amerike a Európe, zokrem, C. J. Kenworthy, B. Lust, I. Aberhart, E. Payer, E. A. Fisch, N. N. Wolff a іnshі. Rusko má o spotrebe ozónu veľmi málo. Tilki za 60-70 rokov v posledných rokoch literatúry z rozsiahleho využívania rozšírenej metódy rozvoja ozónovej terapie a o spotrebe ozónu v populácii malých detí v regióne a v 80. rokoch v histórii nášho Základy základného vývoja technológií ozonoterapie sú vo forme robotov pre Ústav chemickej fyziky Akadémie lekárskych vied ZSSR pomerne rozsiahle. Kniha „Reakcie ozónu a jogína s organickými rečami“ (SD Rozumovskiy, G. Ye. Zaikov, Moskva, 1974) sa stala referenčným bodom pre rozvoj mechanizmov ekonomického rozvoja ozónu u bagatiánov. Medzinárodná asociácia ozónu (IOA) má široké spektrum aktivít, ktoré uskutočnili 20 medzinárodných kongresov a od roku 1991 sa naši lekári a vedy zúčastňujú robotických kongresov. Pozývame novým spôsobom na pohľad na problémy aplikovanej liečby ozónom a na samotnú medicínu. V terapeutickom rozsahu koncentrácií a dávok ozónu je sila push-pull bioregulátora, ktorý je z hľadiska metód tradičnej medicíny pomerne hojný a najčastejšie vo forme monoterapie. Medicínsky ozón Zasosuvannya predstavuje jasnú novinku aktuálnych problémov vo vývoji zdravotných problémov. Technológie ozónovej terapie sa používajú na liečbu v chirurgii, pôrodníctve a gynekológii, zubnom lekárstve, neurológii s terapeutickou patológiou, infekčných chorobách, dermatológii a pohlavných chorobách a v mnohých ďalších. Ozónová terapia sa vyznačuje jednoduchosťou, účinnosťou, dobrou znášanlivosťou, praktickou viditeľnosťou vedľajších účinkov, je ekonomicky životaschopná. Likuvalny výkon ozónu v prípade chorôb unikátna budova vplyv na organiz. Ozón v terapeutických dávkach na imunomodulačné, antipyretické, baktericídne, proti kožné, fungicídne, cytostatické, antistresové a analgetické účinky. Yogo zdatnist aktívne coriguvati poškodzuje kisnevy homeostázu organizmu má veľké vyhliadky na vnútrožilovú medicínu. Široká škála metodických možností umožňuje vzhľadom na veľkú účinnosť vikoristovuvati ozónovej energie pre svalovú a systémovú terapiu. V posledných desiatich rokoch sa do popredia dostávajú metódy, spojené s parenterálnymi (vnútornými, vnútornými, vnútornými, vnútornými) zavedenými terapeutickými dávkami ozónu, aktívnymi systémovými účinkami Kisnevo -ozónový plynný súčet s vysokými (4000 - 8000 μg / l) koncentráciami v nízkom ozóne je účinný v prípade silne zapálených, špinavých rán, gangrény, dekubitov, diagnostiky, plesňových infekcií školy atď. Ozón vo vysokých koncentráciách môže byť tiež použitý ako krvou podporovaný. Nízka koncentrácia ozónu stimuluje opravy, energetickú účinnosť a vznietenie. Pri niektorých kolitídach, proktitídach, noritách a pri mnohých ďalších črevných problémoch je rektálne podanie čiastok plynného kyslého ozónu rektálne. Ozón podľa fyziologického rozkladu úspešne stagnuje počas zápalu pobrušnice na sanáciu čierneho odpadu a ozonizovaná voda sa destiluje v štrbinovej chirurgii a v. Pre vnútorné zavedenie ozónu vikorisovutsya, razchinny na fyziologické razchini abo v krvi chorého človeka. Priekopníci európskej školy sledovali postulát o tých, ktorí pomocou ozónovej terapie Príspevok: „Stimulácia a reaktivácia metabolizmu kyselín bez narušenia oxidačne aktívnych systémov“, - to znamená, že keď sa dávky odoberú na sedenie, kurz. Riling, R. FIBA 1996 v knihe. Cvičenie ozónovej terapie). V zahraničnej lekárskej praxi na parenterálne podávanie ozónu vikoristovuyutsya, v hlavnej, veľkej a malej autohemoterapii. Počas veľkej autohemoterapie bola pacientovi odobratá strecha, aby sa zbavila zmesi plynného kyslíka a ozónu, a okamžite kvapkala späť do žily rovnakého pacienta. Pri malej autohemoterapii sa ozonizovaná strecha zavádza interne. Terapeutická dávka ozónu v celom rozsahu je uvedená pre zmes koncentrácie plynu a ozónu v novom.
Ozonіdi zazvychay škaredé razchinyayutsya pri vode, bohužiaľ, v organických razchinniki. Pri zahrievaní niektoré z prechodných kovov padajú na radikály. Počet ozonidov v organickej forme je jódové číslo. Jódové číslo - hmotnosť jódu v gramoch, ktorá bola pridaná do 100 g organickej reči. Pre mastné kyseliny by jódové číslo nemalo byť 100-400, pre tuhé tuky 35-85, pre tvrdé tuky-150-200. Vpred ozón, ako prvé antiseptikum A. Wolff v roku 1915, prvý krát dňa. Blížiaci sa osud postupne zhromažďoval informácie o úspechu spotreby ozónu v prípade nezákonných chorôb. Vivoristi však boli triviálnu hodinu zbavení metódy ozonoterapie spojenej s priamymi kontaktmi s ozónom z prstencových plôch a tenkých prázdnych priestorov. Mám záujem o terapiu ozónom, keď som vo svete videl akumuláciu údajov o biologickom účinku ozónu na telo, a budete mať možnosť počuť o úspechu testovania ozónu v prípade celého radu chorôb. História zdravotnícky materiál ozón sa opravuje od 19. storočia. Priekopníci klasických dodávok ozónu v Západnej Amerike a Európe, zokrem, C. J. Kenworthy, B. Lust, I. Aberhart, E. Payer, E. A. Fisch, N. N. Wolff a іnshі. Rusko má o spotrebe ozónu veľmi málo. Tilki za 60-70 rokov v posledných rokoch literatúry z rozsiahleho využívania rozšírenej metódy rozvoja ozónovej terapie a o spotrebe ozónu v populácii malých detí v regióne a v 80. rokoch v histórii nášho Základy základného vývoja technológií ozonoterapie sú vo forme robotov pre Ústav chemickej fyziky Akadémie lekárskych vied ZSSR pomerne rozsiahle. Kniha „Reakcie ozónu a jogína s organickými rečami“ (SD Rozumovskiy, G. Ye. Zaikov, Moskva, 1974) sa stala referenčným bodom pre rozvoj mechanizmov ekonomického rozvoja ozónu u bagatiánov. Medzinárodná asociácia ozónu (IOA) má široké spektrum aktivít, ktoré uskutočnili 20 medzinárodných kongresov a od roku 1991 sa naši lekári a vedy zúčastňujú robotických kongresov. Pozývame novým spôsobom na pohľad na problémy aplikovanej liečby ozónom a na samotnú medicínu. V terapeutickom rozsahu koncentrácií a dávok ozónu je sila push-pull bioregulátora, ktorý je z hľadiska metód tradičnej medicíny pomerne hojný a najčastejšie vo forme monoterapie. Medicínsky ozón Zasosuvannya predstavuje jasnú novinku aktuálnych problémov vo vývoji zdravotných problémov. Technológie ozónovej terapie sa používajú na liečbu v chirurgii, pôrodníctve a gynekológii, zubnom lekárstve, neurológii s terapeutickou patológiou, infekčných chorobách, dermatológii a pohlavných chorobách a v mnohých ďalších. Ozónová terapia sa vyznačuje jednoduchosťou, účinnosťou, dobrou znášanlivosťou, praktickou viditeľnosťou vedľajších účinkov, je ekonomicky životaschopná. Likuvalny výkon ozónu v prípade chorôb unikátna budova vplyv na organiz. Ozón v terapeutických dávkach na imunomodulačné, antipyretické, baktericídne, proti kožné, fungicídne, cytostatické, antistresové a analgetické účinky. Yogo zdatnist aktívne coriguvati poškodzuje kisnevy homeostázu organizmu má veľké vyhliadky na vnútrožilovú medicínu. Široká škála metodických možností umožňuje vzhľadom na veľkú účinnosť vikoristovuvati ozónovej energie pre svalovú a systémovú terapiu. V posledných desiatich rokoch sa do popredia dostávajú metódy, spojené s parenterálnymi (vnútornými, vnútornými, vnútornými, vnútornými) zavedenými terapeutickými dávkami ozónu, aktívnymi systémovými účinkami Kisnevo -ozónový plynný súčet s vysokými (4000 - 8000 μg / l) koncentráciami v nízkom ozóne je účinný v prípade silne zapálených, špinavých rán, gangrény, dekubitov, diagnostiky, plesňových infekcií školy atď. Ozón vo vysokých koncentráciách môže byť tiež použitý ako krvou podporovaný. Nízka koncentrácia ozónu stimuluje opravy, energetickú účinnosť a vznietenie. Pri niektorých kolitídach, proktitídach, noritách a pri mnohých ďalších črevných problémoch je rektálne podanie čiastok plynného kyslého ozónu rektálne. Ozón podľa fyziologického rozkladu úspešne stagnuje počas zápalu pobrušnice na sanáciu čierneho odpadu a ozonizovaná voda sa destiluje v štrbinovej chirurgii a v. Pre vnútorné zavedenie ozónu vikorisovutsya, razchinny na fyziologické razchini abo v krvi chorého človeka. Priekopníci európskej školy sledovali postulát o tých, ktorí pomocou ozónovej terapie Príspevok: „Stimulácia a reaktivácia metabolizmu kyselín bez narušenia oxidačne aktívnych systémov“, - to znamená, že keď sa dávky odoberú na sedenie, kurz. Riling, R. FIBA 1996 v knihe. Cvičenie ozónovej terapie). V zahraničnej lekárskej praxi na parenterálne podávanie ozónu vikoristovuyutsya, v hlavnej, veľkej a malej autohemoterapii. Počas veľkej autohemoterapie bola pacientovi odobratá strecha, aby sa zbavila zmesi plynného kyslíka a ozónu, a okamžite kvapkala späť do žily rovnakého pacienta. Pri malej autohemoterapii sa ozonizovaná strecha zavádza interne. Terapeutická dávka ozónu v celom rozsahu je uvedená pre zmes koncentrácie plynu a ozónu v novom. Vedecké úspechy vikariánov sa začali pravidelne aktualizovať na medzinárodných kongresoch a sympóziách
- 1991 - Kuba, Havana,
- 1993 - USA San Francisco,
- 1995 - FranziaLill,
- 1997 rock - Japonsko, Kjóto,
- 1998 - Rakúsko, Salzburg,
- 1999 r. - Nimechchina, Baden-Baden,
- 2001 - Anglicko, Londýn,
- 2005 - Francúzsko, Štrasburg,
- 2009 - Japonsko, Kjóto,
- 2010 rock - Španielsko, Madrid
- 2011 Turecko (Istanbul), Francúzsko (Paríž), Mexiko (Cancún)
- 2012r. - Španielsko Madrid
Všeruské vedecké a praktické konferencie s medzinárodnou ozónovou terapiou
I - „OZÓN V BIOLOGISE TA MEDICINI“ - 1992 r., N. Novgorod II - „OZÓN V BIOLOGISE TA MEDICINI“ - 1995 r., N. Novgorod III - „OZÓN I ÚČINNÉ METÓDY TERAPIE“ - 1998 r., N. Novgorod IV - „OZÓN I ÚČINNÉ METÓDY TERAPIE“ - 2 000 RUR., N. Novgorod V - „OZÓN V BIOLOGISE TA MEDICINI“ - 2003 r., N. Novgorod VI - „OZÓN V BIOLOGISE TA MEDICINI“ - 2005 r., N. Novgorod„I Conference of Ozone Therapy of the Asia -European Union of Ozone Therapists and Medical Health“ - 2006 r., Velikie Boldino, región Nižný Novgorod VII - „OZÓN V BIOLOGISE TA MEDICINI“ - 2007 r., N. Novgorod U111 – „Ozón, aktívna formulácia a metódy intenzívnej terapie v medicíne“ - 2009 N. Novgorod Do roku 2000 Ruská škola ozónovej terapie formulovala svoju vlastnú formu, typ európskej, až do zavedenia ozónu ako záujmu. Hlavným dôvodom je širšie zlepšenie fyziologickej dávky v dávke ozónu, zníženie výrazne nižších koncentrácií a dávok ozónu, fragmentácia technológie mimotelového spracovania veľkých koncentrácií kyslíka v krvi (regenerácia ozónu) V prípade najväčších ruských lekárov najúčinnejšie koncentrácie ozónu vedia, že základný princíp medicíny nie je „náš“. Bezpečnosť a účinnosť ruských metód ozonoterapie bagatorazovogo primárne a priniesla 100 percent k rozvoju oblasti medicíny. Výsledkom základných základných klinických dávok vedcov Nižného Novgorodu z Bula je „Nevyhnutná pravidelnosť formulácie adaptačných mechanizmov v organizmoch pracovníkov so systémovou infúziou nízkych terapeutických dávok ozónu, ktorá spúšťa zosilnenie radikálnych reakcií , čo zase zvýšilo aktivitu enzymatických a neenzymatických lanok antioxidačného systému na zničenie “(Kontorshchikova KN, Peretyagin SP)). Vichiznykhovi roboti poznali vývoj nových technológií a aspekt riadenia ozónu s nasledujúcou výhodou:- Široký sortiment kvality fyziologickej ruže degradovanej ozónom (0,9% roztok NaCl)
- Stagnácia proporcionálne malých koncentrácií a dávok ozónu počas systémovej infúzie (intravaskulárne a intraintestinálne podanie)
- Infúzia vnútornej ozonizácie
- Vnútorné koronárne zavedenie ozonizácie nie je kardioplegické
- Celkové mimotelové ošetrenie ozónom s veľkým prekrvením v prípade kusového krvného obehu
- Nízkoprúdová terapia ozónom a kyslíkom
- Intraportálne zavedenie ozónu
- Zasosuvannya ozón v divadle
- Podporná systémová ozónová terapia s metódami biochemickej kontroly
- Ozónová terapia je nelieková metóda infúzie lyuvalny, ktorá umožňuje eliminovať pozitívne výsledky v prípade patológie genézy.
- Biologická aktivita parenterálne podávaného ozónu sa prejavuje na úrovni nízkych koncentrácií a dávok, na čo dohliadajú klinicky variabilné pozitívne účinky liečiv, ktoré môžu výrazne meniť dávku akumulácie.
- Informovať ruské a európske školy o ozonoterapii o týchto metódach, ako študovať ozón ako lekár, výrazne zlepší účinnosť medikamentóznej terapie a umožní substitúciu liečiv vo farmakológii. Ozónová terapia zároveň zavádza silné kyslé reakcie a procesy chorých organizmov.
- Technické možnosti moderných lekárskych ozonizátorov so silou ultra presného dávkovania umožňujú konzumáciu ozónu v rozmedzí nízkych terapeutických koncentrácií podobných tým, ktoré sa používajú vo farmakologických podmienkach.
7. Kde položiť potrebnú hodinu úpravy vody?
zdravie ozónu zostaňte pri vode a ležte pri teplote
vody a oblastí styku plynu s vodou.
Chim studenejšiu vodu a menšie veľkosti rosіkach,
vypočíta sa menej ozónu. Chim vishche teplotu vody,
Tim shvidshe ozón klesá na kyslosť a je konzumovaný s viparovanny.
Pád z kroku túlanie sa okolo
je potrebná stále väčšia koncentrácia ozónu.
8. Čo je potrebné pre dodatočnú filtráciu
riadiť pislya ozonuvannya?
Voda Yakshcho je mystila skvelé číslo
komplex s polovicou, potom v dôsledku spracovania
ozón v ničom vipadaut rіznі odpadáva.
Tento druh vody je potrebný dodatočné filtrovanie.
Pre množstvo filtrácie si môžete vybrať najjednoduchšie a
lacné filtre.
S tsom zdrojom robх robotov dôjde k významnému pokroku.
9. Chi slides sa bojí náročnej hodiny
ošetrenie ozónom?
Spracovanie vodi nadpozemské množstvo ozónu
Nenechajte sa zaťažiť zubami dedičnosti.
Plyn sa rýchlo zmení na bozk,
Namaľujem len jas vody.
10. Jasný indikátor kyslosti vody,
prešiel ozonuvannya?
voda maє slabá reakcia PH = 7,5 - 9,0.
11. Na skіlshutsya vmest
kyslé vo vode ozonuvannya?
vmist kisnyu vo vode to bude trvať 14 - 15 krát.
12. Ako padá shvidko ozón do vody?
Za dvanásť minút po 10 min. koncentrácia ozónu klesá
na polovicu, oprava vody a vody.
Pri studenej vode po 15-20 minútach. pokles ozónu
polovica, predstiera hydroxylová skupina a vody.
13. Prečo by sme mali piť kyslú vodu?
pidsilyu žiť glukóza tkanivami a orgánmi
zbіlshu nasichuvanostі kyslá krvná plazma
krok zmeny kyslý hlad
farba mikrocirkulácia krvi.
nada pozitívne diyu
O metabolizme pečene a niroku.
do roboty srdcové mäso.
zmeniť frekvenciu dikhannya i
Zbilshu dichny obsyag.
14. Koľko potrebujete ozonvatovú vodu?
chim bolsh weanim voda z domu,
Tim je viac ako hodina spracovania.
Napríklad ozonizácia 3 litrov vody
pôžička 10 - 15 min.
Vydajte sa na rovnakú jazdu odobraté z vôd,
na úhore počas sezóny, skalné a vidiecke oblasti
vinný sa vykonáva v troch-chotiri razi viac.
15. Kto má krajšie ozonová voda v misci alebo v pohári?
Jedlá sú krajšie ako viberati Vydám zvuk
hrdlo (téglik) na zvýšenie koncentrácie
ozón v prepojenej spoločnosti.
16. Ak farbíš vodu na čaj krajšie,
do konca dňa?
Na varenie čaju voda sa neodporúča
doviesť k veci.
Rotácia t = 85-90 ° С.
Pred zahrievaním vykonajte úpravu vody.
17. Je možné ozonizovať minerálnu vodu?
Také vody sú k dispozícii všetky minerály,
Nádherné a zvetrané kyslé.
Chi vás poctil štatútom?
Interakcia medzi ozónom a ozónom je zodpovedná za priamu reakciu s molekulami ozónu alebo dokonca s radikálmi, ktoré sú v procese kvapky. Aktívnejší ozón v spojení s aniónmi, nižší s neutrálnymi a katiónovými slovami.
Ozón, ako aktívne oxidačné činidlo, interaguje s organickými aj anorganickými slovami. S halogénmi s ozónom nereaguje fluór a prakticky nevstupuje do interakcie chlóru. Bróm sa zo zmesi oxiduje ozónom na hypobromit a potom na brómnan zinan. Súčasne je možné vytvárať bromid súbežne s interakciou organickej aktivity s amiakom. Jód sa ešte viac oxiduje ozónom a stáva sa jodičnanom a kyselinou jodičovou. Soli kyselín obsahujúcich halogény nie sú citlivé na oxidáciu ozónu. Prakticky neutrálny voči ozónu - dusík a polovica, vrátane amoniaku a amoniaku, ako aj samotný dusičnan, na vine je aminiv, sú láskavo prepojené s hydroxylovými radikálmi. Toxické kyanidy sú ľahko oxidované ozónom v kyanide, ktorého ďalšia oxidácia rastie ešte častejšie a zrýchľuje sa iba za prítomnosti iónov média, aby sa vysporiadala s prítomnosťou iónov v údolí. Voda a sírany sa v kombinácii s ozónom oxidujú na sírany. Ak existujú reakcie s kovmi, potom sa ozón aktívne oxiduje oxidáciou galiso a mangánu, kobaltu a niklu, peroxidov a hydroxidov, čo je možné vidieť na prelome vločkovania alebo filtrácie. Chróm je prakticky pasívny voči ozónu;
»Článok Ozón na úpravu vody... Budeme hovoriť o skladovaní plynu pre väčšiu čistú vodu.
Ozón na čistenie vody je technológia, ktorá bola na hodinu zmenená. Bilsh nіzh časť európskej krajiny vikoristovuyut ozonuvannya ako krátka metóda čistenia vody. Francúzsko sa stalo prvou krajinou, pretože ozón bol spotrebovaný čistenou vodou.
Hlavným dôvodom vzniku ozónu ako činidla pri úprave vody je skutočnosť, že nie je potrebné kupovať nové prvky, činidlá atď.
Ozón je chemicky aktívna chemická látka, ktorú je možné skladovať z troch atómov. Je pravda, že tretí atóm je ľahké nájsť a aktívne interagovať s vašimi túžbami. Celkovo je založená technológia ozonizácie vody.
Ozón na rozvoj svojho pokročilého reakčného zdravia oxidujúceho organické domy, okrádajúci ich o nekajúcnosť, zväčšujúcich ich s takýmto stupňom, zvyšujúcich účinnosť útočných krokov pri čistení vody
Ozón oxiduje vo vode, zinku, mangáne, dôležitom kove, prekladá ho v nekritickom mlyne a leží ďalej.
Prítomnosť neprijateľných a hlasných pachov. Akonáhle je voda prítomná s vodou a amiakom, potom ozonizácia vody zvýši uvoľnenie týchto slov.
Ozón nad chastkovo antinakіpederavnoe dіyu. Ozonuvannya vod a dôverujúc usadzovaniu vápenatých solí na stenách horúceho potrubia a často videli chladné ložisko.
Moderné technológie ozonizácie zamestnancov provinčného personálu robia každého stále lacnejším. Oskilki efekt ozonuvannya komplex, potom s čistenou vodou pre celé kabíny v blízkosti bagatokh vipadkah, najmä s "dôležitou" vodou, môžete preniesť zahrnutú technológiu.
Zadok organizovania čistenia vody pre ďalší ozón.
Nie je to recept na úpravu vody, ale je to len zobrazené na zadku, pretože sa dá použiť na ozonizáciu pri príprave vody.
Vraj situácia: čistá voda by mala byť nahradená 2,5 mg / l rozbitého fyziologického roztoku, rýchlosť oxidácie je 12 mgO2 / l, kalamita je 5 mg / l, farba je 30 stupňov. Tobto, voda je calamut, zelená, bohatá na organické látky a vlasy. Chi nie je dobrá situácia, zmestí sa do nej aj jednoduchý odstraňovač železa. Ale, pravdaže, mi zbiraєmosya zastosuvati mensh vitratne ozonuvannya.
Základné pravidlo znie, že dávka ozónu na úpravu vody by mala byť 0,14 *, keď je množstvo vody viditeľné, takže 0,14 sa vynásobí koncentráciou vody. Dzherelo prepáč, nepamätám si. Naša dávka ozónu je 0,35 mg / l. Oscilácia oxidácie je komplexný ukazovateľ a v skutočnosti tam nemôže byť, potom je presne možné vyčerpať dávku ozónu iba v praxi. Ozón v našej aplikácii vyžaduje 2 mg / l. Zdá sa, že na 1 000 litrov je potrebných 2 000 miligramov ozónu alebo 2 gramy. 1000 litrov - veľa vody, pretože na doplnenie potrebujete 3 až 3 osoby.
Ozonátory sa líšia podľa produktivity: 1 g / rok, 2 g / rok, 4 g / rok atď. Chim viac gramov za rok, Tim drahý. Je pravda, že ozonizátor vibroval o 1 g / rok. To znamená, že trvá 2 roky, kým sa dostaneme za zadok. Ako budeme dodávať ozón? Je to ešte jednoduchšie - klokotať s kompresorom v hromadiacom sa tresku. Bulbashki naplnené ozónom prechádzajú vodou, oxidujú všetko, čo sa dá oxidovať, a prasknú na vodnú hladinu. Nie je potrebné vidieť vikoristany ozón, aby ozón dokončil otruby. Ako celok na vstup z nádrže je nainštalovaný filter s aktívnymi komponentmi, ako je skladovanie ozónu. Všetko si zaslúži dobré vetranie.
Voda stúpa, telo sa zväčšuje a už je možné filtrovať v počiatočnom štádiu čistenia vody za ďalšími mimoriadnymi filtrami mechanického čistenia typu kazety. Nebudeme sa pozerať na filter z aktív vugillamu a časti priemyselného filtra. Ale tse stále musí žasnúť nad haliermi.
Tiež je potrebný: ozonátor s produktivitou 1 g / rok, skladovacia nádrž na 1 000 litrov, kompresor na dodávanie ozónových výživných súm do nádrže, systém na dodávku ozónu do nádrže, hrubý filter, čerpadlo na stanica, filtre na čistenie vody mechaniky.
Schematicky to bude vyzerať takto:

Otzhe, voda stúpa z horných tokov, aby sa zhromaždila v Umnist. Hladina vody a regulácia plaváka k čerpadlu a solenoidovému ventilu. Všetky naraz sa zapnú až do časovača, ktorý vám umožní vytočiť vodiča iba v noci. Druhý časovač obsahuje ozonátor a kompresor na dodávanie súčasti ozónu a ozónu do vody. Časovač programovania na 2 roky robotov. Po 2 rokoch sa ozonátor a kompresor zapnú.
Po dobu 2 rokov sa ozón spotrebováva v nádrži hadicou s hmoždinkami na rovnomerné dodanie ozónu v celom objeme nádrže. Zalizo oxiduje, organické oxidujú, zápach sa zväčšuje a padá do obkľúčenia.
Potom sa batožina postaví, otvorí kohútik - a čerpacia stanica tiež dodáva vyčistenú vodu prostredníctvom niekoľkých filtrov (napríklad 100 mikrónov, zvlnenie kaziet na 30 mikrónov, kazety na 5 mikrónov a filtre)
Výsledkom je, že voda nezaberá miesto a je to viac ako organická reč.
Aby sme videli domy, ktoré budeme zveľaďovať, bude to trvať jednoducho hodinu ozonizácie. Postup pri experimente jednoduchosti - do nádrže naliali vodu, minul ozón 2 roky, rok, 3 roky, 4 roky a upravil vzhľad vody.
Je potrebné mať na pamäti, že ozón sa vo vode môže stále viac piecť a bude bezpečný pre ľudí na 20 rokov a na vernosti - pre 30 čilínov. Tobto, môžeš piť vodu iba za celú hodinu.
Vazhaєmo hodina: ucho nádrže asi prvý rok v noci. Doplnenie nádrže 2 roky - 3 roky. Hodina na zničenie ozónu vo vode - 30 chilínov. 3.30 noci - voda je pripravená pred víkendom.
Vitrati na projekte minimálneho, od malých prvkov - iba kazety mechanického čistenia v strednej filtrácii, ako sú gule za prítomnosti akejkoľvek schémy úpravy vody - s ozónom a bez ozónu. Druhé zimné prvky a vitrátové materiály sa nepoužívajú - nenahrádzajú katalytickú konzerváciu ani vitrát pre mangán alebo sil.
Chcete užívať ozonátory? V zásade tiché spoločnosti, ktoré sa zaoberajú bazénmi. Smrad a ukáž a ukáž, a môžeš a stoj.
Tak, ozonuvannya so správnym prístupom - tse komplexné čistenie vody.

Pre materiály http://voda.blox.ua/2008/10/Kak-vybrat-filtr-dlya-vody-34.html
Pri bežných umývadlách je ozón plynom podobná neplodná reč so štipľavým zápachom volodya. Vvazhaєtsya, kde je vôňa ozónu vôňou čerstvých potravín, ohrozujete. Stojí to za to, aj keď iba v takom prípade je koncentrácia ešte nižšia a stáva sa zlomkom hraničnej prípustnej koncentrácie (HDC). Podrobný popis fyzikálnych a chemických síl ozónu je možné vidieť v numerických robotoch, zokrem. deyakі main fyzikálne a chemické orgány Usmernenie k ozónu v tabuľke 1.1.
1.1. Základná fyzikálna a chemická sila pre ozón.
Tolerancia ozónu vo vode
Keď sa ozón určuje vo vode, jeho koncentrácia sa postupne zvyšuje a dosahuje hraničné hodnoty pre tieto podmienky. (Voz / Vv) alebo v absolútnych hodnotách pre ozón (g / l). Zároveň je dôležité, aby bol rozhodovací proces v súlade s Henryho zákonom, ale množstvo ozónu je úmerné uchopeniu plynného ozónu nad roztokom.
Cstat = β M Pγ, g / l
De: Cstats - odolnosť voči ozónu, g / l; β - Bunsenov koeficient; M - koncentrácia ozónu = 2,14 g / l; Pγ je čiastočné zachytenie ozónu v otvorenom plynovom prostredí.
To znamená, že ozón je zodpovedný za hlavné atmosférické plyny - dusík a kyslosť, o niečo menej oxidačné činidlá, ako sú chlór a oxid chloričitý. Rozpustenie ozónu sa pri nižších teplotách vody rýchlo mení.
Distribúcia ozónu vo vode
Jednu hodinu sa ozón dodáva do vody. Pri širokej rýchlosti prvej kvapky, ako zväčšenej hodnote „hodiny života“, je možné akumulovať sa predovšetkým na teplote vody, a predovšetkým v zásobníku vody, pretože sa prejavuje voda malých domov, najmä organických kovových prameňov. Poloha dobra, ktorá má byť ilustrovaná údajmi, zameraná na malého 1.2. 
Malunok 1.2. ... Distribúcia ozónu v iných druhoch vôd pri teplote 20 ° C.
- Dvakrát destilovaná voda. 2. Destilujte. 3. Zalievajte „kohútik Z-pid“. 4. Voda jazera Tsurikhovskoye bola filtrovaná.
Hodina života v jednorazovej destilovanej vode je 20 hilín a v mimoriadnej vode je postrek hilínom.
Reakcia na ozón anorganickými slovami.
Ozón môže reagovať s rastom, ktorý sa vo vode nachádza dvoma rôznymi mechanizmami: bez stredu ako ozónu (v molekulárnej forme) a v prítomnosti radikálu OH *, ako víno, keď ozón padá do vody. Vvazhaєtsya, scho v neutrálnej vode 2 kanály reakcií rozpodіlenі príležitostne. V kyslom strede má spätná fermentácia molekulárny mechanizmus a v lenivej je radikálna. Ozónové škvrny v chemických reakciách, ako je oxidácia, možno posúdiť o ich oxidačnom zdraví podľa takzvanej veľkosti oxidového potenciálu. Hodnoty hodnôt oxidačných potenciálov malých riek, ako aj oxidačných potenciálov, uvádza tabuľka 1.3.
oxidujúce |
Oxidačný potenciál (Volt) |
Predstaviť. Oksli. potenciál až do jamy OK. chlór |
hydroxylový radikál |
||
atómová kyselina |
||
Peroxid |
||
kyselina chloronuvatová |
||
oxid chloričitý |
||
Tabuľka 1.3. viplyaє, ozón je najsilnejšie oxidačné činidlo. V prípade stabilných hovorcov sa používa iba fluór, reakčnú rýchlosť na ozón je možné hodnotiť pre hrubé tekutiny v reakcii na ne a množstvo reakcie na ozón možno posúdiť podľa miery reakcie. Chastkovo tsі danі predstavené dieťaťu 1.3.
Reakcia na ozón s kovmi
Ľahko sa oxidujú ozónom a hydroxidom manganatým a oxidom manganičitým. Manganistan môže pre túto reakciu tiež tvrdiť: 2Mn + ² + 5O3 + 3H2O □ 2MnO4ˉ + 3O2 + 6H + Súbežne s cymovým procesom sa vykonáva proces - strata mangánu z rozsahu:
2Mn + ² + 2O3 + 4H2O □ 2MnO (OH) 2 ↓ + 2O2 + 4H + Oxidácia iónov v oxidoch mangánu, kobalte a nikli sa používa v kvapalinách, pretože hodnoty konštant likvidity 1 / kvapalina sú dané poradím veľkosti. Chróm je možné oxidovať na šesťmocný chróm. Proces skladania, vimag špeciálnych myslí. 5 6 Olovo sa oxiduje ozónom PbO2 s reakčnou konštantou blízkou 10 -10 l / mol sek. Kovy, ktoré vytvárajú komplexy s EDTA, ako sú Pb, Ni, Cd a Mn, niekedy prechádzajú fázou zničenia komplexu a potom oxidujú. Takéto reakcie sú spôsobené komplexáciou kovov s prírodnými humínovými kyselinami.
Reakcia na ozón organické spoluky.
Elektronická štruktúra bipolárneho ozónu: z jednej strany - negatívna, z druhej - pozitívna. Z tohto dôvodu môže ozón reagovať súčasne tak elektrofilne, ako aj nukleofilne. Podobne sa pri reakcii priamej oxidácie riek ozónom vo vode transformuje elektrofilný mechanizmus. Rozumovskiy. Je veľmi dôležité uviesť charakteristiku reakcie všetkých hlavných organických fráz s ozónom. Pri pohľade priamo do ozónu je to možné veliteľstvo: Nasické alkoholické zlúčeniny reagujú s ozónom ešte častejšie. Väčšina chlórovaných uhľohydrátov a navitov, nenasýtených v uhľohydrátoch, nereagujú bez ozónu. Vo všeobecnosti je potrebné interakciu s ozónom sprostredkovať prostredníctvom radikálu OH. Benzén je oxidovaný ozónom častejšie a polycyklické v sacharidoch častejšie.
Hodina reakcie na ozón s fenolickými polovicami sa stáva niekoľko sekúnd. Chastkovova reakčná schéma pre fenol je predstavená na 1.5. Iontový fenát reaguje rýchlejšie, menej protonizovaný fenol. Znamená to, že konštantná rýchlosť je ešte väčšia a blíži sa fenolom Riznoi Budovia. Karboxylové kyseliny, ketónové kyseliny a množstvo podobných produktov sú stabilnými produktmi procesu oxidácie organických kvapalín ozónom. Amini pri neutrálnych hodnotách pH reagujú s ozónom, pri pH> 8 prebiehajú oxidačné reakcie rýchlejšie. V zásade však reakcia oxidačného amínu prebieha cez radikály OH. Štvrťročné aminy (aromatické aminy) reagujú s ozónom. Alkohol môže interagovať s ozónom, čo umožňuje medziprodukt hydroperoxidu spoluk. Celým zápachom sa oxiduje na karboxylové kyseliny, v tú hodinu, ako druhé alkoholy, na ketóny. Kyseliny uhličité reagujú slabo s ozónom alebo nereagujú s ozónom.
Mercaptan sa oxiduje ozónom na sulfónové kyseliny. Bisulfit a sulfonovy Aminokyseliny pred skladom, medzi ktoré patrí sirka (cysteín, cestín a methionín), reagujú rýchlo. Aminokyseliny (skladová časť bilkivu) reagujú elektrickým mechanizmom. Medzi pesticídmi, aby sa pomstili esteru kyseliny fosforečnej, je najlepšou formou paratión. Ozonuvannya tsyogo z'єdnannya produkovať pred objavením sa paraoxónu, ktorý je toxickejší, s nízkym parationom. Ďalšia ozonizácia znova transformuje paraoxón na menej toxickú reč (napríklad na nitrofenol, ktorý sa potom oxiduje na konečné produkty - dusičnan a CO2).
Pri odbere vzoriek pitnej vody je mechanizmus priamej oxidácie prostredníctvom ozónu v molekulárnej forme základný. Konštanty veľkého počtu organických látok s ozónom sú uvedené v súhrne Hoigne.
- Ozón ako aktivátor mikroflóry.
Akonáhle sa jedlo pokazí, ozón vynúti baktericídny a virulentný (antivírusový) účinok. dobré hodnoteniaÚčinnosť mladých dezinfekčných prostriedkov dobre ilustrujú údaje o mladom chlapcovi 2.1.

Malunok 2.1. Rýchlosť dekontaminácie patogénnych E-coli rôznymi deaktivačnými činidlami.
V danej hodine sa pri hodnotení účinnosti tohto dezinfekčného prostriedku nazýva kritérium Z x T, takže sa koncentrácia činidla upraví na hodinu. Je možné povedať, že DIA (inaktivácia) = koncentračná hodina expozície Tabuľka 2.1. uvedená pre príslušnú hodnotu kritérií SHT pre malé mikroorganizmy - dezinfekčné činidlá Tabuľka 2.1. Kritérium CGT pre malé mikroorganizmy (99% inaktivácia pri 5-25 ° C. Kritérium CGT (Mb / L xv))
pohľad na mikroorganizmy |
PH ozónu: 6/7 |
Vilny chlór pH: 6/7 |
Chloramín pH: 8/9 |
Oxid chloričitý pH: 6/7 |
poliovírus |
||||
rotavírusy |
||||
Gardialyamblasti |
||||
Gardia myurizmus |
||||
Kryptosporídium |
||||
Na 90% deaktiváciu (1 denník) |
Ozón očividne má prednosť pred dezinfekčnými prostriedkami, ako je chlór, chlóramín a chlorid dioxidy. V prípade takých patogénov, ako sú črevné tyčinky (E-coli), je ozón účinnejší, menej chlóru, o niečo viac. V rovnakú hodinu, pokiaľ ide o kryptosporídium, sa kritériá pre dezinfekčné prostriedky blížia k 1 000. Pri prevode môže ozón v zásade konkurovať takýmto dezinfekčným činidlám, ako je chlór, bróm, jód, kyselina chlorovodíková, kyselina chlorovodíková vyrobená, chlorovodíková, yak, podľa vlastného uváženia, disociácia vo vode pre generálneho riaditeľa aniónov a katión N. Zistilo sa, že pri pH = 8 je koncentrácia nerozpustenej kyseliny ≈ 20%a pri pH = 7 je koncentrácia HClO ≈80%. Pretože je to silný baktericídny účinok nízkeho obsahu HCLO, potom vicorijským chlórom (v prítomnosti chlórnanu) je potrebné znížiť optimálnu hodnotu pH. Iod, ako dezinfekčný prostriedok, v prípade vikristických flotačných systémov, ktoré nie sú vhodné na zhoršovanie stavu vodou. Vďaka svojej dezinfekčnej sile je jód slabší ako chlór a viac ako ozón, ale je účinnejší v doprave. Nízka hodnota GDK. Problémom je schválenie bromičnanov pri ozonizácii brómom; Všetky pachy sa však môžu zdať ako určité nedostatky a ako skvelé predĺženie do súčasnej hodiny. “ V dánsku hodinu sa chlór premýva v špeciálnom prístroji-chlorečnane, keď na elektrolytizáciu kuchynskej soli alebo chlórnan, ktorý sa nachádza vo vode, vyžaduje koncentráciu voľného chlóru. Všeobecne je potrebné pre termín „silný chlór“ zvýšiť koncentráciu chlórovanej kyseliny a HClO. Testovanie chlorátora vyžaduje rezervu činidla a chlórnan, keď sa rozkladá, vypadáva z chlóru. - Chlór, odpadový plyn (GDK pre chlór je 1 mg / m³). Vyhrajte vpershe buv vikoristaniy yak boyova otruyna zasib v persha svitovu vіynu Existuje mnoho obetí tohto tyrana. Ozón možno klasifikovať ako toxické plyny a HDC môže dosiahnuť nízku úroveň (0,1 mg / m³). Našťastie má ozón super silný charakteristický zápach a ľudia vnímajú prítomnosť ozónu v niektorých z predchádzajúcich, nižších koncentrácií stále nebezpečných hodnôt (vôňa ≈ 0,1 / 0,5 GDK). Je potrebné sa postarať o to, aby bola pred touto hodinou bezprecedentne smrteľná, každopádne, dôležitá, ktorá je v stave hospitalizácie, vodka dezon ozón. Nutričná toxicita ozónu sa nebude posudzovať oddelene. Jednou z hlavných nevhodných vlastností chlóru je, že v prípade reakcie s veľkým počtom organických zlúčenín je spektrum detí s organickým chlórom, veľké množstvo chlóru a jedovatých jedov. Od najsilnejších druhov v Dánsku dôjde k organickému narušeniu a navyše v populácii v zničenom imunitnom systéme bude veľa toxínov. Takže, keď hovoríme o dioxínoch, inodi vikoristovuyt termín "chemické SNID". Celkom reč sa dá urobiť so slabým dezinfekčným prostriedkom a trochu povrchne silne dráždi sliznice očí a nosohltana. Chloramini sa často nazýva „viazané chlórom“. Celý rad chlórových obväzov je 5-10 krát silnejší promótor, menej chlóru.Ozón je možné použiť aj na priemyselné použitie (vedľajšie produkty) na ozonizáciu plynov a kondenzovaných zmesí. Teoreticky je možné pripustiť, že ho akceptujú produkty toxickejšie a menej ozónové. Tento problém je predmetom mnohých rokov. Koncentrácia a sklad priemyselných riek, ktoré sú zistené pri ozonizácii, dokonca ležia, pretože voda je ozón. Bláznivo, prvé miesto, ktoré predstiera, že je menej podľa produktov a skladu, je očividnejšie. Na všetko jedlo sa bude pozerať zo všeobecnej distribúcie v okolí. Je možné zhrnúť, aby sme dokončili jedlo z bagárov do nasledujúcej triedy:
- Drvivá väčšina priemyselných výrobkov, oxidovaných ozónom, je menej toxických a menej toxických.
- Priama korelácia medziľahlých rečí, ktorá sa robí počas experimentálnych experimentov s chloráciou a ozonizáciou, ukázala, že v prvom rade je dôležitejšie predstierať, že je viac vedľajšími produktmi.
2.1. Dezinfekcia chlóru a ozónu na priemyselných čistiacich staniciach a v laboratórnych mysliach.
Bagatorická história registrácie dvoch dezinfekčných prostriedkov vo veľkých čistiarňach vody s cieľom pomstiť množstvo faktického materiálu, aby bolo možné posúdiť ich kríženie a nedostatky. V spodnej časti „Ozonuvannya Vody“ sa generuje množstvo príkladov
Na filtračnej stanici Belmont vo Philadelphii (USA) poskytla ozonizácia vody úspešnejšie výsledky z hľadiska e-coli, nižšie výsledky sa dosiahli chloráciou. Účinok kontaminácie vody ozónom v prípade extravagantných množstiev baktérií v 1 ml 800-1 200 od. stať sa: pri dávke 1 ml / l ozónu - 60-65%, pri dávke 2 ml / l - 85%, pri dávke 3 ml / l - 90-95%. Prijateľná dávka ozónu sa pridala do 3-4 ml / l na vodárenskej stanici Rublevskaja (stanica metra v Moskve). Vykonala sa ozonizácia vôd riek Moskva. Množstvo baktérií v 1 ml vody sa znížilo o 92 až 99% v intervaloch medzi hodinami 1 až 25 minút. Baktericídna dávka ozónu bola daná taká pre plnivo, ktorým nemôže byť e-coli v 500 ml. riadiť. Úprava kalamity od 6,8 do 12 mg / l a sfarbenia od 3,2 do 18 Greden. Inimálne na zvýšenie baktericídnej dávky ozónu z 3,2 na 4,1 mg / l. Stanice „Rydenor“ a „Ingols“ z USA boli poliate suspenziou chlóru a ozónu e-coli v destilovanej vode pri Hp = 6,8 a pri teplote 1 ° C, takže 99% kolónií e-coli odumrelo, stali sa 0,25 až 0,3 mg / l počas 16 minút pre chlór a 0,5 mg / l počas 1 minúty pre ozón. Graf 2.3. je zrejmé, že krivka bakteriologického poklesu je spôsobená zvýšeným dávkovaním chlóru a navyše dochádza k približne exponenciálnemu poklesu počtu baktérií. V prípade ozonizácie existuje obrázok - pri nízkych koncentráciách ozónu je množstvo ozónu v baktérii nevýznamné, ale je korigované z veľmi kritickej dávky (0,3 - 0,5 mg / l) ozón sa výrazne zvyšuje a zvyšuje množstvo chlóru v mikroflóre, v určitej časti Na baktericídnu aktivitu je potrebný ozón. hodina spevu... Celá hmota baktérií je zároveň ozón. Chlór viroblyaє vibіrkovе otrunnya zhitєvyh centerіv bakterіy, navyše je potrebné pridať viac po potrebe triviálnej hodiny na difúziu v protoplazme.
Graf prežitia baktérií pri úprave vody ozónom a chlórom----ozón -------- chlór
2.4. Diya ozón na superprúdoch, cystách a iných patogénoch.
Ozón je tiež účinným bakteriálnym činiteľom z hľadiska mikroflóry. Podľa Bringmanna bol Bacillus subtilis náchylný na ozón vo vode 3000 -krát viac, menej chlóru. M. Kane a Glöckner injekčne podali ozón a chlór na cysty (tenké membrány, ktoré sú založené na asi jednoriadkových organizmoch) Endamoeba hystolica na baktérie, podtypy kultúr. Inštalovaný, asi hodinu, je potrebný na vyčerpanie cich organizmov s prebytočnou koncentráciou ozónu 0,3 mg / l, sklad 2-7,5 minúty a pre chlór (nadbytočná koncentrácia 0,5-1 mg / l) pre viac chlóru - 15-20 minút.
Diya ozón na vírus
Ozón nadása virazhene, radikálna infúzia mnohých vírusov, na ktorú dohliada stále viac chumáčov vírusových bielkovín. V štyridsiatych a šesťdesiatych rokoch minulého storočia americkí vírusológovia a spoločnosť Nimechchines vykonali množstvo ďalších testov so suspenziami polyeemilitového vírusu s prídavkom ďalšieho chlóru, ozónu a oxidu chloričitého. Kresby od Tsikh po Sihdzhen môžu byť predstavené urážlivým pohľadom:
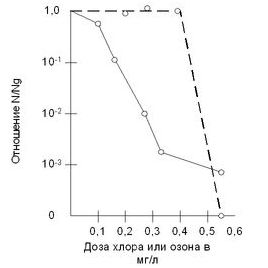
- Inaktiváciu vírusu polioemility chlórom je možné dosiahnuť v dávke 0,1 mg / l pri teplote vody 18 ° C, pri teplote vody 7 ° C a dávka chlóru nie je nižšia ako 0,25 mg / l.
- Inaktiváciu vírusu pre ďalší ozón je možné dosiahnuť dávkou 0,1 mg / l pri teplote vody 18 ° C, pri studenej vode pri -7 ° C je dávka spôsobená ale zvýšená na 0,15 mg / l.
- V prípade dymoxidu vicorianskeho potrebuje chlór dávku 0,6 mg / l (18 ° C). Pri vode s teplotou 7 ° C je dávka oxidu chloričitého zodpovedná za 1 mg / l.
Podľa pocty Naumanna je potrebný polyeemilit zenizyutsya ozón 2 minúty pri koncentrácii 0,45 mg / l, raz za hodinu chlorácie s dávkou 1 mg / l počas 3 rokov.
Ozón a hydrobionti
Podľa názoru mnohých autorov ozón úspešne asimiloval mikro-vodný rast a jednoduchší, aktívnejší a menej chlóru. Najľahší je teda ozón s koncentráciou 15 mg / l po dobu 3 minút, pretože si zachováva svoju aktivitu, keď sa triviálne hodiny odoberajú s dávkou chlóru 250 mg / l. Pri dávke 0,9 - 1,0 mg / l ozónu larvy mäkkýše dresenia stratili 90%, pri dávke 2 mg / l - 98%, pri dávke 3 mg / l - vzrástli. Dlhšie formy mäkkýšov sa stratili, keď boli triviálnejšie s ozonizovanou vodou (až 30 minút). Je pravda, že veľa vody chcete divoko pestovať v blízkosti veľmi kritických nádrží na ospalých svetlách, slabých až po ozón. Tu vikoristovuyut šokové dávky chlóru. Vykonávať čistenie v noci počas preventívneho čistenia takýchto bazénov. Zásobením vakov extrémne krátkym ozónom, chlórom a oxidom chloričitým, ako prostriedkom na čistenie a dezinfekciu vody, je zrejmé Ak chcete vidieť roboty čistiarní vody, ako ozón a chlór, zvýšim zníženie ozónu na škoricu. V. F. Kozhinov, ktorý zriadil francúzsku stanicu na prípravu vody v Saint-Maure a stanicu v Chicagu (USA), teda znamená, že prvý pád neduhov „vodnej dopravy“ bol zaregistrovaný na 1 pád na 100 tis. Obyvatelia, ktorí chcú koncentráciu prebytočného ozónu vo vode, nepresiahli 0,05 mg / l. V rovnakú hodinu, v Chicagu, existovalo v Chicagu malé mesto choroby čriev, ktoré nebolo ovplyvnené chlórom ani zďaleka od vodovodu.) Taku si myslel: „Naybіlsh іstotnyh zaprechennya proti ozonuvannya zvvazyayut vіvazhayut vіdnіtnі ozón prebytočný ozón v distribučnej fenestrácii vody, ako za hodinu chlorácie v množstve akumulácie prebytku. “ Experimenty uskutočnené v Ashtone (Anglicko) ukázali, že pri dezinfekcii ozónovou vodou, ktorá cirkuluje v referenčných vodovodných potrubiach, nedochádza k zhoršeniu kvality. Kontrolné vzorky ozónovej vody odobraté z živého plota sa ukázali byť úplne rovnaké ako vzorky odobraté z dzherelu, aby bolo možné prebytočný chlór vo vode odstrániť. ... To znamená, že prítomnosť prebytočného chlóru v potrubiach neznamená rovnakú bakteriálnu čistotu vody. Jeden z autorov diskutoval o probléme s vedúcimi vodárenského systému Tsurikhovsky a schválil myšlienku, že dezinfekčné prostriedky na prenos ozónu M.T.B. sú nespochybniteľné. Vzhľadom na silu sa na ozón nebudem pozerať. Nareshti, problém podobnosti. Myslím si, že ozonuvannya je oveľa drahšia ako chloruvannya. Nie je to však tak. Pri procese chlorácie vína je potrebné chlór naliať do vody a vykonať takzvanú dechloráciu. Na odstránenie vody a dobrej kvality sa pracuje a používajú sa špeciálne činidlá. Vzhľadom na zhoršenie faktora, ako aj tendenciu nepretržitého znižovania cien dodávok ozónu a zvyšovania cien chlóru a chlórových produktov je v tejto hodine frekvencia týchto procesov porovnateľná. Na čo? Є počet dôvodov: - psychologický dôvod. Pratsyuvati s chlórom, najmä pokiaľ ide o baloni s rіdky chlórom, je to celkom jednoduché. Dodať vetracie otvory balónika alebo kapacitu do bazéna vo forme chlórnanu, ako všetky problémy s dezinfekciou vírusu. Cena, šialené, jednoduchšie, žiadne pátranie po koncentrácii ozónu, ako ísť z ozonátora, ale ozonátor je voľne zložený a musíme ho zmeniť, ale nie je možné vypnúť. Rozšírenie na ozón. Až do poslednej hodiny bola potreba vlastníctva ozonátora príliš veľký bastard a nízky rіven avtomatizatsії pripuskayut neobhіdnіst vikoristannya obslugovuyuchogo personál schody visokoї kvalіfіkatsіі.Suschestvenny prielom v problemі stvorennya nadіynogo, ťažkopádny v vikoristannі ozonizácia aj ozonoіzmerіtelnogo obladnannya sa objavil mozhlivim pіslya Suchasnyj IGBT tranzistorіv scho dovolili rіzko sprostiti aj zdesheviti virobnitstvo іmpulsnih visokovoltnih generatorіv, rozvitok mіkroprotsesornoї tehnіki aj novih tipіv ultrafіoletovih senzory, špeciálne syntetické zeolity a in. Všetky ceny, ako aj výsledky oneskorenia impulzných elektrických výbojov v minulosti umožnili vývoj technologické riešenia Zaviedli sme nové možnosti výroby ozonátorov v nesušených potravinách, kyslé ozonizátory, systémy na monitorovanie prebytočného ozónu vo vode, ozonometer, kisnyu koncentrátor To je najlepšie vlastníctvo, ako zabrániť tomu, aby ozonuvannya zonuvannya nagato odpúšťala a bola šikovná, ale nie skôr. Naše rádiá, naša posledná generácia a distribúcia, ktorých sa zmocnili patenty v Rusku, USA, Japonsku a ďalších krajinách, pomôžu životu jednoduchších ľudí bez požehnania a pomôžme im to.
Zoznam literatúry
Draginsky V.L., Aleksova L.P., Samoilovich V.G. „Ozonuvannya v procesoch čistenia vody“ M. Deli print. 2007 r
.Нж. V.V. Karaffa-Korbutt „Ozón“ a jogín zasosuvannya V priemysle a zdravotníctve „Ed. "Osvita" SPP. 1912 RUR
V.F. Kozhinov, I.V. Kozhinov „Ozonuvannya Vodi“ M. Stroyizdat 1973 r
V.V. Lukin, M.P. Popovich, S.N. Tkachenko "Fyzikálna chémia ozónu" Ed. MSU 1998r.
Manley T.S., Negowski S.J. Ozón v encyklopédii chemickej technológie. Druhý ed. Zväzok 14. N.J. +1967.
Hozvath M. H., Bilitrki, haud., Huttez. "Ozón" Ed. Akademie. Kiado. Budapešť tisíc deväťsto šesťdesiat sedem
Kogan B.F. ja br. „Dovidnik on razchinnosti“ v.1, kniha. 1, M. tisíc deväťsto šesťdesiat jedna.
Masschelein W.J. „Procesy spracovania jednej pitnej vody“ Ed. CEBEIOC. Hiege. 1996.
Jore M., hegube B.J. Er. Hydrol. 14.11.1983.
Cowen W. Fetal. „Chémia vo vode znova“. Ed. Ann. Azboz. Science Publ. Michigan. 1985.
Curol M.D. Obálka Prog. 4.46.1985.
Hoigne J. "In Progress Technologies for treatment water" Ed. Plénum. Stlačte # 3. +1988
Rozumovskiy S.D. a Zaika G.Z. „Reakcie ozónu a jogína s organickými spolu“ M. 1974.
Hubner R. Gesundheitstechnik č. 12. 1 973.
Dojbido J. Etol. „Osvita priemyselných riek v procese ozonizácie a chlorácie“ Wat. Res. 1999. 33. č. 4 р3111 - 3118.
Ridenour G.M., Inglols R.S. American Jounal of Public Health 1946. 3.6s 639.
Gomella C. 2e treitment d eux par l ozone. Extrahovať du mensuel du ceutre Belge 287,1,967.
Kozhinov V.F. Ozonuvannya vodi. „Miske Gospodarstvo Moskvy“ 1970. č. 7.
Steinhardt. Stadtehygiena. 1S. 1956.
Naumman E. „Das gas nnd Wassertach“ 1952. NY.p. 81.
Dickerman J.M. etral. Journ of New England Water Works Ass. 1.11.1954.
Shalashova E.S. „Vymenovanie ozónu na čistenie vody životom štátu“ №6. 1960.
Thorp C. E. Jnd Med a Surg. 1950. v19 s 49
M.U. 2.1.2.694-98. „Vikoristannya ultrafialové vimіrі v prípade infikovaných vôd bazénov“.
G.I. Rogozhkin. „Čistenie a infekcia vody v bazénoch“ Santekhnika. 4.2003. strana 4-9.
