Властивості озону, його взаємодія з різними речовинами і області застосування. Розчинення озону в воді Озон розчиняється в воді
ОЗОН (О 3) - аллотропная модифікація кисню, його молекула складається з трьох атомів кисню і може існувати у всіх трьох агрегатних станах. Молекула озону має кутову структуру в формі рівнобедреного трикутника з вершиною 127 o. Однак замкнутого трикутника не утворюється, а молекула має будова ланцюга з 3-х атомів кисню з відстанню між ними 0,224 нм. Відповідно до цієї молекулярною структурою дипольний момент складає 0,55 дебай. В електронній структурі молекули озону є 18 електронів, які утворюють мезомерностабільную систему, існуючу в різних прикордонних станах. Прикордонні іонні структури відображають дипольний характер молекули озону і пояснюють його специфічне реакційний поведінку в порівнянні з киснем, який утворює радикал з двома неспареними електронами. Молекула озону складається з трьох атомів кисню. Хімічна формула цього газу-O 3 Реакція утворення озону: 3O 2 + 68 ккал / моль (285 кДж / моль) ⇄ 2O 3 Молекулярна маса озону - 48 При кімнатній температуріозон - це безбарвний газ з характерним запахом. Запах озону відчувається при концентрації 10 -7 М. В рідкому стані озон - це темно-синій колір з температурою плавлення -192,50 С. Твердий озон є кристали чорного кольору з температурою кипіння -111,9 гр.С. При температурі 0 гр. і 1 атм. = 101,3 кПа щільність озону становить 2,143 г / л. У газоподібному стані озон диамагнитен і виштовхується з магнітного поля, в рідкому -слабопарамагнітен, тобто володіє власним магнітним полемі втягується в магнітне поле.
Хімічні властивості озону
Молекула озону нестійка і при достатніх концентраціях в повітрі при нормальних умовах мимоволі перетворюється в двоатомний кисень з виділенням тепла. Підвищення температури і зниження тиску збільшують швидкість розкладання озону. Контакт озону навіть з малими кількостями органічних речовин, Деяких металів або їх оксидів різко прискорює перетворення. Хімічна активність озону дуже велика, це сильний окислювач. Він окисляє майже всі метали (за винятком золота, платини і іридію) і багато неметали. Продуктом реакції в основному є кисень. Озон розчиняється в воді краще, ніж кисень, утворюючи нестійкі розчини, причому швидкість його розкладання в розчині в 5 -8 разів вище, ніж в газовій фазі, ніж в газовій фазі (Розумовський С.Д., 1990). Це обумовлено, по-очевидно, не специфікою конденсованої фази, а його реакціями з домішками і іоном гідроксилу, оскільки швидкість розпаду дуже чутлива до вмісту домішок і рН. Розчинність озону в розчинах хлориду натрію підкоряється закону Генрі. Зі збільшенням концентрації NaCl у водному розчині розчинність озону зменшується (Таруніна В.Н. і співавт., 1983). Озон має дуже високу спорідненість до електрону (1,9 еВ), що й обумовлює його властивості сильного окислювача, превосходімого тільки фтором (Розумовський С.Д., 1990).Біологічні властивості озону і його вплив на організм людини
Висока окислююча здатність і те, що в багатьох хімічних реакціях, що протікають за участю озону, утворюються вільні радикали кисню, роблять цей газ вкрай небезпечним для людини. Як газоподібний озон впливає на людину:- Дратує і пошкоджує тканини органів дихання;
- Впливає на холестерин в крові людини, утворюючи нерозчинні форми, що призводить до атеросклерозу;
- Довге знаходження в середовищі з підвищеною концентрацією озону може стати причиною чоловічого безпліддя.
- Максимальна разова гранично допустима концентрація (ГДК м.р.) в атмосферному повітрінаселених місць 0,16 мг / м 3
- Середньодобова гранично допустима концентрація (ГДК с.с.) - 0,03 мг / м 3
- Гранично допустима концентрація (ГДК) в повітрі робочої зони - 0,1 мг / м 3 (при цьому, поріг людського нюху наближено дорівнює 0,01 мг / м 3).
Шкідливі і корисні властивості озону
Озон присутній в двох шарах атмосфери. Тропосферний або приземний озон, що знаходиться в найближчому до поверхні Землі шарі атмосфери-в тропосфері - небезпечний. Він шкідливий і для людини, і для інших живих організмів. Він згубно впливає на дерева, посіви сільськогосподарських культур. Крім того, тропосферний озон-один з головних "інгредієнтів" міського смогу. У той же час стратосферний озон дуже корисний. Руйнування утвореного ним озонового шару (озонового екрану) призводить до того, що потік ультрафіолетового випромінювання на земну поверхню збільшується. Через це зростає кількість захворювань на рак шкіри (в тому числі найбільш небезпечного його виду-меланоми), випадків катаракти. Вплив жорсткого ультрафіолету послаблює імунітет. Надмірне УФ-випромінювання може також стати проблемою для сільського господарства, Так як посіви деяких культур надзвичайно чутливі до ультрафіолету. У той же час слід пам'ятати, що озон - отруйний газ, і на рівні земної поверхнівін є шкідливим забруднювачем. Влітку через інтенсивного сонячного випромінювання і спеки в повітрі утворюється особливо багато шкідливого озону.Взаємодія озону і кисню один з одним. Подібності та відмінності.
Озон - аллотропная форма кисню. Аллотропия - існування одного і того ж хімічного елемента у вигляді двох і більше простих речовин. В даному випадку і озон (O3) та кисень (O 2) утворені хімічним елементомО. Отримання озону з кисню Як правило, вихідною речовиною для отримання озону виступає молекулярний кисень (O 2), а сам процес описується рівнянням 3O 2 → 2O 3. Ця реакція ендотермічна і легко оборотна. Для зміщення рівноваги в бік цільового продукту (озону) застосовуються певні заходи. Один із способів отримання озону - використання дугового розряду. Термічна дисоціація молекул різко зростає з ростом температури. Так, при Т = 3000К - зміст атомарного кисню становить ~ 10%. Температуру в кілька тисяч градусів можна отримати за допомогою дугового розряду. Однак при високій температурі озон розкладається швидше молекулярного кисню. Щоб запобігти цьому, можна змістити рівновагу, спочатку нагрів газ, а потім різко його охолодивши. Озон в даному випадку-проміжний продукт при переході суміші O 2 + O до молекулярного кисню. Максимальна концентрація O 3, яку можна отримати при такому способі виробництва, досягає 1%. Цього достатньо для більшості промислових цілей. Окисні властивості озонуОзон - потужний окислювач, набагато більш реакційноздатні в порівнянні з двоатомний киснем. Окисляє майже всі метали і багато неметали з утворенням кисню: 2 Cu 2+ (aq) + 2 H 3 O + (aq) + O 3 (g) → 2 Cu 3+ (aq) + 3 H 2 O (1) + O 2 (g) Озон може брати участь в реакціях горіння, температура горіння при цьому вище, ніж при горінні в атмосфері двухатомного кисню: 3 C 4 N 2 + 4 O 3 → 12 CO + 3 N 2 Стандартний потенціал озону дорівнює 2.07 в, тому молекула озону нестійка і мимоволі перетворюється в кисень з виділенням тепла. При невеликих концентраціях озон розкладається повільно, при високих - з вибухом, тому що його молекула має надлишкову енергією. Нагрівання і контакт озону з мізерними кількостями органічних речовин (гідроксиду, перекису, метали змінної валентності, їх оксиди) різко прискорює перетворення. Навпаки, присутність невеликих кількостей азотної кислоти стабілізує озон, а в судинах зі скла і деяких пластмас або чистих металів озон при -78 0 C. практично розкладається. Спорідненість озону до електрону дорівнює 2 ев. Таким сильним спорідненістю володіє тільки фтор та його оксиди. Озон окисляє всі метали (за винятком золота і платинових), а також більшість інших елементів. Хлор бере участь в реакціях з озоном з утворенням гіпохлорит ОCL. Реакції озону з атомарним воднем є джерелом утворення гідроксильних радикалів. Озон має максимум поглинання в УФ-області при довжині хвилі 253,7 нм з молярним коефіцієнтом екстінціі: E = 2,900 На підставі цього УФ-фотометричне визначення концентрації озону разом з йодо-метричних титруванням прийнято за міжнародні стандарти. Кисень, на відміну від озону, в реакцію з KI не вступає.Розчинність озону і його стабільність у водних розчинах
Швидкість розкладання озону в розчині в 5-8 разів вище, ніж в газовій фазі. Розчинність озону в воді в 10 разів вище, ніж кисню. За даними різних авторів величина коефіцієнта розчинності озону в воді коливається від 0,49 до 0,64 мл озону / мл води. В ідеальних термодинамічних умовах рівновагу підкоряється закону Генрі, тобто концентрація насиченого розчину газу пропорційна його парціальному тиску. C S = B × d × Рi де: С S - концентрація насиченого розчину в воді; d - маса озону; Pi - парціальний тиск озону; B - коефіцієнт розчинення; Виконання закону Генрі для озону як метастабільного газу умовно. Розпад озону в газовій фазі залежить від парціального тиску. У водному середовищі мають місце процеси, що виходять за область дії закону Генрі. Замість нього в ідеальних умовах діє закон Gibs-Dukem-Margulesdu. У практиці прийнято виражати розчинність озону в воді через співвідношення концентрації озону в рідкому середовищі до концентрації озону в газовій фазі: Насичення озоном залежить від температури і якості води, оскільки органічні і неорганічні домішки змінюють рН середовища. При однакових умовах у водопровідній воді концентрація озону становить 13 mg / l, в бидистиллированной воді - 20mg / l. Причиною цього є значний розпад озону через різних іонних домішок у питній воді.Розпад озону і період напіврозпаду (т 1/2)
У водному середовищі розпад озону сильно залежить від якості води, температури і рН середовища. Підвищення рН середовища прискорює розпад озону і знижує при цьому концентрацію озону в воді. Аналогічні процеси відбуваються при підвищенні температури. Період напіврозпаду озону в бидистиллированной воді становить 10 годин, в демінералізованої воді - 80 хвилин; в дистильованої воді - 120 хвилин. Відомо, що розкладання озону в воді є складним процесом реакцій радикальних кіл: Максимальна кількість озону у водному зразку спостерігається протягом 8-15 хвилин. Через 1 годину в розчині відзначаються тільки вільні радикали кисню. Серед них найважливішим є гідроксильний радикал (ОН ') (Staehelin G., 1985), і це необхідно брати до уваги при використанні озонованою води в терапевтичних цілях. Оскільки в клінічній практиці знаходять застосування озонована вода і озоноване фізіологічний розчин, нами проведена оцінка цих озоноване рідин в залежності від концентрацій, які використовуються у вітчизняній медицині. Основними методами аналізу з'явилися йодометрической титрування і інтенсивність хемілюмінесценції з використанням приладу біохемілюмінометра БХЛ-06 (виробництво Нижній Новгород) (Конторщикова К. Н., Перетягін С. П., Іванова І. П. 1995). Явище хемилюминесценции пов'язано з реакціями рекомбінації вільних радикалів, що утворюються при розкладанні озону в воді. При обробці 500 мл бі- або дистильованої води барботированием озоно-кисневої газовою сумішшю з концентрацією озону в межах 1000-1500 мкг / л і швидкістю потоку газу 1 л / хв протягом 20 хвилин хемілюмінесценція виявляється протягом 160 хвилин. Причому в бидистиллированной воді інтенсивність світіння істотно вище, ніж в дистильованої, що пояснюється наявністю домішок, що гасять світіння. Розчинність озону в розчинах NaCl підкоряється закону Генрі, тобто зменшується зі збільшенням концентрації солей. Фізіологічний розчин обробляли озоном з концентрацією 400, 800 і 1000 мкг / л протягом 15 хвилин. Загальна інтенсивність світіння (в mv) збільшувалася із зростанням концентрації озону. Тривалість світіння становить 20 хвилин. Це пояснюється більш швидкої рекомбинацией вільних радикалів і звідси гасінням світіння за рахунок наявності в фізіологічному розчині домішок. Незважаючи на високий окислювальний потенціал, озон має високу селективність, яка обумовлена полярним будовою молекули. Миттєво реагують з озоном сполуки, що містять вільні подвійні зв'язку (-С = С-). В результаті чутливими до дії озону є ненасичені жирні кислоти, ароматичні амінокислоти і пептиди, перш за все містять SH- групи. Згідно з даними Кріге (1953) (цит. По Vieban R. 1994), первинним продуктом взаємодії молекули озону з біоорганічними субстратами є 1-3 диполярного молекула. Ця реакція є основною при взаємодії озону з органічними субстратами при рН< 7,4.
Озонолиз проходит в доли секунды. В растворах скорость этой реакции равна 105 г/моль·с. В первом акте реакции образуется пи-комплекс олефинов с озоном. Он относительно стабилен при температуре 140 0 С и затем превращается в первичный озонид (молозонид) 1,2,3-триоксалан. Другое возможное направление реакции — образование эпоксидных соединений.
Первичный озонид нестабилен и распадается с образованием карбоксильного соединения и карбонилоксида. В результате взаимодействия карбонилоксида с карбонильным соединением образуется биполярный ион, который затем превращается во вторичный озонид 1,2,3 — триоксалан. Последний при восстановлении распадается с образованием смеси 2-х карбонильных соединений, с дальнейшим образованием пероксида (I) и озонида (II).
Максимальна кількість озону у водному зразку спостерігається протягом 8-15 хвилин. Через 1 годину в розчині відзначаються тільки вільні радикали кисню. Серед них найважливішим є гідроксильний радикал (ОН ') (Staehelin G., 1985), і це необхідно брати до уваги при використанні озонованою води в терапевтичних цілях. Оскільки в клінічній практиці знаходять застосування озонована вода і озоноване фізіологічний розчин, нами проведена оцінка цих озоноване рідин в залежності від концентрацій, які використовуються у вітчизняній медицині. Основними методами аналізу з'явилися йодометрической титрування і інтенсивність хемілюмінесценції з використанням приладу біохемілюмінометра БХЛ-06 (виробництво Нижній Новгород) (Конторщикова К. Н., Перетягін С. П., Іванова І. П. 1995). Явище хемилюминесценции пов'язано з реакціями рекомбінації вільних радикалів, що утворюються при розкладанні озону в воді. При обробці 500 мл бі- або дистильованої води барботированием озоно-кисневої газовою сумішшю з концентрацією озону в межах 1000-1500 мкг / л і швидкістю потоку газу 1 л / хв протягом 20 хвилин хемілюмінесценція виявляється протягом 160 хвилин. Причому в бидистиллированной воді інтенсивність світіння істотно вище, ніж в дистильованої, що пояснюється наявністю домішок, що гасять світіння. Розчинність озону в розчинах NaCl підкоряється закону Генрі, тобто зменшується зі збільшенням концентрації солей. Фізіологічний розчин обробляли озоном з концентрацією 400, 800 і 1000 мкг / л протягом 15 хвилин. Загальна інтенсивність світіння (в mv) збільшувалася із зростанням концентрації озону. Тривалість світіння становить 20 хвилин. Це пояснюється більш швидкої рекомбинацией вільних радикалів і звідси гасінням світіння за рахунок наявності в фізіологічному розчині домішок. Незважаючи на високий окислювальний потенціал, озон має високу селективність, яка обумовлена полярним будовою молекули. Миттєво реагують з озоном сполуки, що містять вільні подвійні зв'язку (-С = С-). В результаті чутливими до дії озону є ненасичені жирні кислоти, ароматичні амінокислоти і пептиди, перш за все містять SH- групи. Згідно з даними Кріге (1953) (цит. По Vieban R. 1994), первинним продуктом взаємодії молекули озону з біоорганічними субстратами є 1-3 диполярного молекула. Ця реакція є основною при взаємодії озону з органічними субстратами при рН< 7,4.
Озонолиз проходит в доли секунды. В растворах скорость этой реакции равна 105 г/моль·с. В первом акте реакции образуется пи-комплекс олефинов с озоном. Он относительно стабилен при температуре 140 0 С и затем превращается в первичный озонид (молозонид) 1,2,3-триоксалан. Другое возможное направление реакции — образование эпоксидных соединений.
Первичный озонид нестабилен и распадается с образованием карбоксильного соединения и карбонилоксида. В результате взаимодействия карбонилоксида с карбонильным соединением образуется биполярный ион, который затем превращается во вторичный озонид 1,2,3 — триоксалан. Последний при восстановлении распадается с образованием смеси 2-х карбонильных соединений, с дальнейшим образованием пероксида (I) и озонида (II).
 Озонування ароматичних сполук протікає з утворенням полімерних озонідов. Приєднання озону порушує ароматичне сполучення в ядрі і вимагає витрат енергії, тому швидкість озонування гомологів корелює з енергією сполучення. Озонування насушенних вуглеводнів пов'язано з механізмом впровадження. Озонування сіро і азотовмісних органічних сполук протікає в такий спосіб:
Озонування ароматичних сполук протікає з утворенням полімерних озонідов. Приєднання озону порушує ароматичне сполучення в ядрі і вимагає витрат енергії, тому швидкість озонування гомологів корелює з енергією сполучення. Озонування насушенних вуглеводнів пов'язано з механізмом впровадження. Озонування сіро і азотовмісних органічних сполук протікає в такий спосіб:  Озоніди зазвичай погано розчиняються у воді, але добре в органічних розчинниках. При нагріванні, дії перехідних металів розпадаються на радикали. Кількість озонідов в органічному поєднанні визначається йодним числом. Йодне число - маса йоду в грамах, що приєдналася до 100 г органічної речовини. У нормі для жирних кислот йодне число становить 100-400, для твердих жирів 35-85, для рідких жирів - 150-200. Вперше озон, як антисептичний засіб був випробуваний A. Wolff ще в 1915 під час першої світової війни. Наступні роки поступово накопичувалася інформація про успішне застосування озону при лікуванні різних захворювань. Однак тривалий час використовувалися лише методи озонотерапії, пов'язані з прямими контактами озону з зовнішніми поверхнями і різними порожнинами тіла. Інтерес до озонотерапії посилювався в міру накопичення даних про біологічну дію озону на організм і появи повідомлень з різних клінік світу про успішне використання озону при лікуванні цілого ряду захворювань. Історія медичного застосуванняозону починається з XIX століття. Піонерами клінічного застосування озону були західні вчені Америки і Європи, зокрема, C. J. Kenworthy, B. Lust, I. Aberhart, Е. Payer, E. A. Fisch, Н. Н. Wolff і інші. У Росії про лікувальному застосуванні озону було відомо мало. Тільки в 60-70 роки у вітчизняній літературі з'явилося кілька робіт по інгаляційної озонотерапії і по застосуванню озону в лікуванні деяких шкірних захворювань, а з 80-х років в нашій країні цей метод став інтенсивно розроблятися і отримувати більш широке поширення. Основи для фундаментальних розробок технологій озонотерапії були багато в чому визначені роботами Інституту хімічної фізики АМН СРСР. Книга «Озон і його реакції з органічними речовинами» (С. Д. Розумовський, Г. Е. Зайков, Москва, 1974 г.) стала відправною точкою для обґрунтування механізмів лікувальної дії озону у багатьох розробників. У світі широко діє Міжнародна озонова асоціація (IOA), яка провела 20 міжнародних конгресів, а з 1991 року в роботі цих конгресів беруть участь і наші лікарі та науковці. Зовсім по-новому сьогодні розглядаються проблеми прикладного використання озону, а саме в медицині. У терапевтичному діапазоні концентрацій і доз озон проявляє властивості потужного биорегулятора, кошти, здатного багато в чому посилити методи традиційної медицини, а найчастіше виступати в якості засобу монотерапії. Застосування медичного озону представляє якісно нове вирішення актуальних проблем лікування багатьох захворювань. Технології озонотерапії використовуються в хірургії, акушерстві та гінекології, стоматології, неврології, при терапевтичної патології, інфекційних хворобах, дерматології та венеричні хвороби і цілому ряді інших захворювань. Для озонотерапії характерна простота виконання, висока ефективність, добра переносимість, практична відсутність побічних дій, вона економічно вигідна. Лікувальні властивості озону при захворюваннях різної етіології засновані на його унікальній здатностівпливати на організм. Озон в терапевтичних дозах діє як імуномодулюючий, протизапальний, бактерицидну, противірусну, фунгіцидну, цитостатичну, антистресову і аналгезирующее засіб. Його здатність активно коригувати порушений кисневий гомеостаз організму відкриває великі перспективи для відновлювальної медицини. Широкий спектр методичних можливостей дозволяє з великою ефективністю використовувати лікувальні властивості озону для місцевої і системної терапії. В останні десятиліття на передній план вийшли методи, пов'язані з парентеральним (внутрішньовенним, внутрішньом'язовим, внутрішньосуглобовим, підшкірним) введенням терапевтичних доз озону, лікувальний ефект яких пов'язаний, в основному, з активізацією різних систем життєдіяльності організму. Киснево-озонова газова суміш при високих (4000 - 8000 мкг / л) концентраціях в ній озону в ефективна при обробці сильно інфікованих, погано гояться ран, гангрени, пролежнів, опіків, грибкових ураженнях шкіри і т.п. Озон в високих концентраціях можна також використовувати як кровоспинний засіб. Низькі концентрації озону стимулюють репарацію, сприяють епітелізації і загоєнню. У лікуванні колітів, проктити, нориць і ряду інших захворювань кишечника використовують ректальне введення киснево-озонової газової суміші. Озон, розчинений у фізіологічному розчині, успішно застосовують при перитоніті для санації черевної порожнини, а озоновану дистильовану воду в щелепної хірургії та ін. Для внутрішньовенного введення використовується озон, розчинений у фізіологічному розчині або в крові хворого. Піонерами Європейської школи було висловлено постулює положення про те, що головною метою озонотерапіїє: «Стимуляція і реактивація кисневого метаболізму без порушення окисно-відновних систем», - це означає, що при розрахунку доз на сеанс або курс, озонотерапевтіческое вплив має перебувати в межах, в яких ферментативно вирівнюються радикальні кисневі метаболіти або надлишково отриманий пероксид »(З . Ріллінг, Р. ФІБА 1996 в кн. Практика озонотерапії).У зарубіжній медичній практиці для парентерального введення озону використовуються, в основному, велика і мала аутогемотерапії. При проведенні великої аутогемотерапії, взята у пацієнта кров ретельно змішується з певним обсягом киснево-озонової газової суміші, і відразу ж крапельно вводиться назад у вену того ж пацієнта. При малої аутогемотерапії озонована кров вводиться внутрішньом'язово. Терапевтична доза озону в цьому випадку витримується за рахунок фіксованих обсягів газу і концентрації озону в ньому.
Озоніди зазвичай погано розчиняються у воді, але добре в органічних розчинниках. При нагріванні, дії перехідних металів розпадаються на радикали. Кількість озонідов в органічному поєднанні визначається йодним числом. Йодне число - маса йоду в грамах, що приєдналася до 100 г органічної речовини. У нормі для жирних кислот йодне число становить 100-400, для твердих жирів 35-85, для рідких жирів - 150-200. Вперше озон, як антисептичний засіб був випробуваний A. Wolff ще в 1915 під час першої світової війни. Наступні роки поступово накопичувалася інформація про успішне застосування озону при лікуванні різних захворювань. Однак тривалий час використовувалися лише методи озонотерапії, пов'язані з прямими контактами озону з зовнішніми поверхнями і різними порожнинами тіла. Інтерес до озонотерапії посилювався в міру накопичення даних про біологічну дію озону на організм і появи повідомлень з різних клінік світу про успішне використання озону при лікуванні цілого ряду захворювань. Історія медичного застосуванняозону починається з XIX століття. Піонерами клінічного застосування озону були західні вчені Америки і Європи, зокрема, C. J. Kenworthy, B. Lust, I. Aberhart, Е. Payer, E. A. Fisch, Н. Н. Wolff і інші. У Росії про лікувальному застосуванні озону було відомо мало. Тільки в 60-70 роки у вітчизняній літературі з'явилося кілька робіт по інгаляційної озонотерапії і по застосуванню озону в лікуванні деяких шкірних захворювань, а з 80-х років в нашій країні цей метод став інтенсивно розроблятися і отримувати більш широке поширення. Основи для фундаментальних розробок технологій озонотерапії були багато в чому визначені роботами Інституту хімічної фізики АМН СРСР. Книга «Озон і його реакції з органічними речовинами» (С. Д. Розумовський, Г. Е. Зайков, Москва, 1974 г.) стала відправною точкою для обґрунтування механізмів лікувальної дії озону у багатьох розробників. У світі широко діє Міжнародна озонова асоціація (IOA), яка провела 20 міжнародних конгресів, а з 1991 року в роботі цих конгресів беруть участь і наші лікарі та науковці. Зовсім по-новому сьогодні розглядаються проблеми прикладного використання озону, а саме в медицині. У терапевтичному діапазоні концентрацій і доз озон проявляє властивості потужного биорегулятора, кошти, здатного багато в чому посилити методи традиційної медицини, а найчастіше виступати в якості засобу монотерапії. Застосування медичного озону представляє якісно нове вирішення актуальних проблем лікування багатьох захворювань. Технології озонотерапії використовуються в хірургії, акушерстві та гінекології, стоматології, неврології, при терапевтичної патології, інфекційних хворобах, дерматології та венеричні хвороби і цілому ряді інших захворювань. Для озонотерапії характерна простота виконання, висока ефективність, добра переносимість, практична відсутність побічних дій, вона економічно вигідна. Лікувальні властивості озону при захворюваннях різної етіології засновані на його унікальній здатностівпливати на організм. Озон в терапевтичних дозах діє як імуномодулюючий, протизапальний, бактерицидну, противірусну, фунгіцидну, цитостатичну, антистресову і аналгезирующее засіб. Його здатність активно коригувати порушений кисневий гомеостаз організму відкриває великі перспективи для відновлювальної медицини. Широкий спектр методичних можливостей дозволяє з великою ефективністю використовувати лікувальні властивості озону для місцевої і системної терапії. В останні десятиліття на передній план вийшли методи, пов'язані з парентеральним (внутрішньовенним, внутрішньом'язовим, внутрішньосуглобовим, підшкірним) введенням терапевтичних доз озону, лікувальний ефект яких пов'язаний, в основному, з активізацією різних систем життєдіяльності організму. Киснево-озонова газова суміш при високих (4000 - 8000 мкг / л) концентраціях в ній озону в ефективна при обробці сильно інфікованих, погано гояться ран, гангрени, пролежнів, опіків, грибкових ураженнях шкіри і т.п. Озон в високих концентраціях можна також використовувати як кровоспинний засіб. Низькі концентрації озону стимулюють репарацію, сприяють епітелізації і загоєнню. У лікуванні колітів, проктити, нориць і ряду інших захворювань кишечника використовують ректальне введення киснево-озонової газової суміші. Озон, розчинений у фізіологічному розчині, успішно застосовують при перитоніті для санації черевної порожнини, а озоновану дистильовану воду в щелепної хірургії та ін. Для внутрішньовенного введення використовується озон, розчинений у фізіологічному розчині або в крові хворого. Піонерами Європейської школи було висловлено постулює положення про те, що головною метою озонотерапіїє: «Стимуляція і реактивація кисневого метаболізму без порушення окисно-відновних систем», - це означає, що при розрахунку доз на сеанс або курс, озонотерапевтіческое вплив має перебувати в межах, в яких ферментативно вирівнюються радикальні кисневі метаболіти або надлишково отриманий пероксид »(З . Ріллінг, Р. ФІБА 1996 в кн. Практика озонотерапії).У зарубіжній медичній практиці для парентерального введення озону використовуються, в основному, велика і мала аутогемотерапії. При проведенні великої аутогемотерапії, взята у пацієнта кров ретельно змішується з певним обсягом киснево-озонової газової суміші, і відразу ж крапельно вводиться назад у вену того ж пацієнта. При малої аутогемотерапії озонована кров вводиться внутрішньом'язово. Терапевтична доза озону в цьому випадку витримується за рахунок фіксованих обсягів газу і концентрації озону в ньому. Наукові досягнення вітчизняних вчених стали регулярно доповідатиметься на міжнародних конгресах і симпозіумах
- 1991 г. - Куба, Гавана,
- 1993 г. - США Сан-Франциско,
- 1995 г. - ФранціяЛілль,
- 1997 року - Японія, Кіото,
- 1998 г. - Австрія, Зальцбург,
- 1999р. - Німеччина, Баден-Баден,
- 2001 г. - Англія, Лондон,
- 2005 - Франція, Страсбург,
- 2009 г. - Японія, Кіото,
- 2010 року - Іспанія, Мадрид
- 2011 г.Турція (Стамбул), Франція (Париж), Мексика (Канкун)
- 2012р. - Іспанія Мадрид
Всеросійські науково-практичні конференції з Міжнародним яких залучено озонотерапії
I - «ОЗОН В БІОЛОГІЇ ТА МЕДИЦИНІ» - 1992 р., Н.Новгород II - «ОЗОН В БІОЛОГІЇ ТА МЕДИЦИНІ» - 1995 р., Н.Новгород III - «ОЗОН І МЕТОДИ ЕФЕРЕНТНОЇ ТЕРАПІЇ» - 1998 р., Н.Новгород IV - «ОЗОН І МЕТОДИ ЕФЕРЕНТНОЇ ТЕРАПІЇ» - 2000 р., Н.Новгород V - «ОЗОН В БІОЛОГІЇ ТА МЕДИЦИНІ» - 2003 р., Н.Новгород VI - «ОЗОН В БІОЛОГІЇ ТА МЕДИЦИНІ» - 2005 р., Н.Новгород«I Конференція з озонотерапії Азіатсько-Європейського союзу озонотерапевтів і виробників медобладнання» - 2006 р., Велике Болдіно, Нижегородська область VII - «ОЗОН В БІОЛОГІЇ ТА МЕДИЦИНІ» - 2007 р., Н.НовгородУ111 – «Озон, активні форми кисню і методи інтенсивної терапії в медицині» - 2009 г.Н.Новгород До 2000 р Російська школа озонотерапії остаточно сформувала свій, відмінний від Європейського, підхід до застосування озону як лікувальний засіб. Головні відмінності - широке використання фізіологічного розчину в якості носія озону, застосування значно нижчих концентрацій і доз озону, розроблені технології екстракорпоральної обробки великих обсягів крові (озоноване штучний кровообіг), індивідуальний вибір доз і концентрацій озону при системної озонотерапії. У прагненні більшості російських лікарів використовувати найменші з ефективних концентрацій озону знайшов відображення основний принцип медицини - «не нашкодь». Безпека і ефективність Російських методик озонотерапії багаторазово обгрунтована і доведена стосовно до різних областей медицини. В результаті багаторічних фундаментально-клінічних досліджень нижегородскими вченими була «Встановлено невідома закономірність формування адаптаційних механізмів організму ссавців при системному впливі низькими терапевтичними дозами озону, яка полягає в тому, що пусковим механізмом є вплив озону на про- та антиоксидантний баланс організму і обумовлена помірною інтенсифікацією вільно- радикальних реакцій, що, в свою чергу, збільшує активність ферментативного і неферментативного ланок антиоксидантної системи захисту »(Конторщикова К. Н., Перетягін С. П.), на яку автори отримали відкриття (Диплом № 309 від 16 травня 2006 року). У роботах вітчизняних вчених знайшли розвиток нові технології і аспекти використання озону з лікувальною метою:- Широке використання в якості носія розчиненого озону фізіологічного розчину (0,9% розчин NaCl)
- Застосування порівняно малих концентрацій і доз озону при системному впливі (внутрішньосудинне і внутрикишечное введення)
- Внутрішньокістковий вливання озоноване розчинів
- Внутрішньокоронарне введення озоноване кардіоплегічним розчинів
- Тотальна екстракорпоральна обробка озоном великих обсягів крові при штучному кровообігу
- Низкопоточной озонокислородна терапія
- Внутріпортальное введення озоноване розчинів
- Застосування озону на театрі військових дій
- Супровід системної озонотерапії методами біохімічного контролю
- Озонотерапія - немедикаментозний метод лікувального впливу, що дозволяє отримувати позитивні результати при патології різного генезу.
- Біологічна дія парентерально введеного озонупроявляється на рівні низьких концентрацій і доз, що супроводжується клінічно вираженими позитивними лікувальними ефектами, що мають чітко виражену дозозалежність.
- Досвід Російської та Європейської шкіл озонотерапії свідчить про те, що використання озону в якості лікарського засобу значно підвищує ефективність лікарської терапії, дозволяє в ряді випадків замінити або зменшити фармакологічне навантаження на пацієнта. На тлі озонотерапії відновлюються власні киснево реакції і процеси хворого організму.
- Технічні можливості сучасних медичних озонаторів, що володіють можливостями сверхточной дозування, дозволяють застосовувати озон в діапазоні низьких терапевтичних концентрацій аналогічно загальноприйнятим фармакологічних засобів.
7. Від чого залежить необхідний час обробки води?
здатність озонурозчинятися у воді залежить від температури
води і площі контакту газів з водою.
Чим холодніше водаі менше розмір розсікача,
тим менше озону буде розчинено. Чим вище температура води,
тим швидше озон розпадається до кисню і втрачається при випаровуванні.
Залежно від ступенязабруднення води
необхідні більші чи менші концентрації озону.
8. Чи необхідна додаткова фільтрація
води після озонування?
Якщо вода містилавелика кількість
комплексних сполук, то в результаті обробки
озоном в ній випадають різні опади.
Таку воду необхіднододатково фільтрувати.
Для цієї фільтрації можна використовувати найпростіші і
дешеві фільтри.
При цьому ресурсїх роботи буде значно продовжений.
9. Чи слід боятися тривалого часу
обробки води озоном?
Обробка водинадмірною кількістю озону
не тягне за собою згубних наслідків.
Газ швидко перетворюється в кисень,
що тільки покращує якість води.
10. Який показник кислотності води,
пройшла озонування?
вода маєслаболужну реакцію PH = 7,5 - 9,0.
11. На скільки збільшується вміст
кисню в воді після озонування?
вміст киснюв воді збільшується в 14 - 15 разів.
12. Як швидко розпадається озон в повітрі, у воді?
В повітрі через 10 хв.концентрація озону зменшується
на половину, утворюючи кисень і воду.
У холодній воді через 15-20 хв. озон розпадається
на половину, утворюючи гідроксильну групуі воду.
13. Чому корисно пити насичену киснем воду?
підсилює споживанняглюкози тканинами і органами
збільшує насичуваностікиснем плазми крові
зменшує ступінькисневого голодування
покращуємікроциркуляцію крові.
надаєпозитивну дію
На метаболізм печінки і нирок.
підтримує роботусерцевого м'яза.
зменшує частотудихання і
Збільшує дихальний обсяг.
14. Як довго треба озонувати воду?
чим більш насиченимдомішками вода,
тим довше час обробки.
Так, наприклад, озонування 3л водопровідної води
займає 10 - 15 хв.
Такий же обсяг води,взятої з водойми,
в залежності від сезону року і рівня забруднення
повинен проводитися в три-чотири рази довше.
15. У чому краще озонувати воду в мисці або банку?
Посуд краще вибиратискляну з звужується
горлом (банку) для створення більшої концентрації
озону в обмеженому обсязі.
16. Коли краще обробляти воду для чаю,
до або після кип'ятіння?
Для заварювання чаюводу не рекомендується
доводити до кипіння.
Краща t = 85-90 ° С.
Обробку води проводити до нагрівання.
17. Чи можна озонувати мінеральну воду?
У такій воді зберігаютьсявсі мінерали,
вона стає безпечною і насиченою киснем.
Чи сподобалася вам стаття?
Взаємодія забруднюючих речовин з озоном відбувається за рахунок прямої реакції з молекулами озону або ж з радикалами, що з'являються в процесі його розпаду. Більш активно озон взаємодіє з аніонами, ніж з нейтральними і катіонними речовинами.
Озон, будучи активним окислювачем, взаємодіє з багатьма органічними і неорганічними речовинами. З галогенів з озоном не реагує фтор і практично не вступає у взаємодію хлор. Бром окислюється озоном спочатку до гіпоброміту, а потім і до броматних з'єднань. При цьому утворюється бромід може паралельно взаємодіяти з речовинами органічного походження і аміаком. Йод окислюється озоном дуже високою швидкістю і утворюються йодатів і йодноватістой кислоти. Солі галогеносодержащих кислот вже не піддаються озоновому окислення. Практично нейтральними до озону є азот і його сполуки, в тому числі аміак і іони амонію, а так само нітрати, за винятком амінів, добре взаємодіють з гідроксильними радикалами. Токсичні ціаніди легко окислюються озоном в ціанати, подальше окислення яких відбувається дуже повільно і прискорюється тільки в присутності іонів міді, сповільняться при наявності в розчині іонів заліза. Сірка і сульфітні при взаємодії з озоном окислюються до сульфатів. Що ж стосується реакцій з металами, то озон досить активно окисляє залізо і марганець, кобальт і нікель, утворюючи оксиди і гідроксиди, що видаляються з розчину при флокуляції або фільтрації. Практично пасивний щодо озону хром, хоча за певних умов він може бути окислений їм до максимальному ступені окислення, шестивалентного хрому.
»статтею Озон для водоочищення. Де поговоримо про застосування цього газу для створення більш чистої води.
Озон для водоочищення - технологія, яка перевірена часом. Більш ніж сторіччя європейські країни використовують озонування як кращий метод очищення води. Першою країною, яка застосувала озон при очищенні води стала Франція.
Головна відмінність озону як реагенту в водопідготовки в порівнянні з іншими речовинами в тому, що виробляється він з навколишнього повітря, не вимагаючи закупівлі змінних елементів, реагентів і т.д ..
Озон - це активна хімічна сполука, що складається з трьох атомів кисню. Це з'єднання настабільно, третій зайвий атом кисню легко відщеплюється і понад-активно взаємодіє з оточуючими сполуками. На цьому явищі заснована технологія озонування води.
Озон за рахунок своєї підвищеної реакційної здатності окисляє органічні домішки, робить їх нерозчинними, сприяє їх укрупнення і, таким чином, збільшує ефективність наступних ступенів очищення води, де ці сполуки фільтруються.
Озон окисляє розчинені у воді залізо, марганець, важкі метали, переводить їх у нерозчинний стан і полегшує їх подальше видалення.
Відсутність неприємних і шкідливих запахів. Якщо у воді присутні сірководень і аміак, то озонування води повністю позбавляє від цих речовин.
Озон надає часткове антінакіпеобразовательное дію. Озонування води уповільнює утворення солей кальцію на стінках гарячого трубопроводу і частково видаляє існуючий крейдяний наліт.
Сучасні технології озонування завдяки використанню напівпровідників стають все менш і менш дорогими. Оскільки ефект озонування комплексний, то при очищенні води на весь будинок у багатьох випадках, особливо з «важкою» водою, можна передбачити включення цієї технології.
Приклад організації очищення води за допомогою озону.
Це не рецепт від усіх бід, це спроба показати на прикладі, як може застосовуватися озонування в водопідготовки.
Припустимо, ситуація: вихідна вода містить 2,5 мг / л розчиненого заліза, окислюваність 12 мгО2 / л, каламутність 5 мг / л, кольоровість 30 градусів. Тобто, вода каламутна, зелена, багато органіки і заліза. Чи не найгірша ситуація, з цим може впорається простий обезжелезіватель. Але, припустимо, ми збираємося застосувати менш витратне озонування.
Існує еміпріческое правило, за яким доза озону для обробки води при видаленні заліза становить 0,14 *, тобто 0,14 помножити на концентрацію заліза. Джерело на жаль не пам'ятаю. У нашому випадку доза озону складе 0,35 мг / л. Оскільки окислюваність - це комплексний показник, і насправді не відомо, що там знаходиться, то точно розрахувати дозу озону можна тільки на практиці. Орієнтовно озону в нашому прикладі потрібно 2 мг / л. Відповідно, на 1000 літрів потрібно 2000 міліграм озону, або 2 грами. 1000 литров - це та кількість води, яке потрібно сім'ї з 3-4 чоловік на добу.
Озонатори діляться по продуктивності: 1 г / год, 2 г / год, 4 г / год і т.д. Чим більше грамів на годину, тим дорожче. Припустимо, ми вибрали озонатор на 1 г / год. Значить, для обробки води за нашим прикладом знадобиться 2 години. Як будемо подавати озон? Дуже просто - компресором пробульківать в накопичувальному баці. Бульбашки повітря, насиченого озоном, проходять через воду, окислюють все, що можна окислити, і лопаються на поверхні води. Не використаний озон потрібно видаляти, так як озон досить отруйний. Для цього на виході з бака встановлюється фільтр з активованим вугіллям, який розкладає озон. Все це повинно знаходитися в добре вентильованому приміщенні.
Вода відстоюється, залізо і органіка укрупнюються, і їх уже можна відфільтрувати на наступній стадії очищення води за допомогою звичайних фільтрів механічного очищення картриджного типу. Не зайвим виявиться фільтр з активованим вугіллям і сітчастий промивний фільтр. Але це вже потрібно дивитися по грошах.
Отже, потрібні: озонатор продуктивністю 1 г / год, накопичувальний бак на 1000 літрів, компресор для подачі озоно-повітряної суміші в бак, система подачі озону в бак, фільтр грубої очистки, насосна станція, фільтри механічної очистки води.
Схематично це буде виглядати так:

Отже, вода надходить зі свердловини, набирається в ємність. Рівень води регулює поплавок від насосу і соленоїдний клапан. Все разом підключається до таймера, який дозволяє набір води тільки вночі. Інший таймер включає озонатор і компресор для подачі повітряно-озонової суміші в воду. Таймер запрограмований на 2 години роботи. Через 2 години він відключає озонатор і компресор.
За ці 2 години озон з повітрям потрапляють в бак через шланг з дірочками для рівномірної подачі озону по всьому об'єму бака. Залізо окислюється, органіка окислюється, вони укрупнюються і випадають в осад.
Далі мешканці будинку встають, відкривають кран - і насосна станція подає вже очищену воду через ряд фільтрів (наприклад, сітчастий на 100 мікрон, картріджний гофрований на 30 мікрон, картріджний на 5 мікрон і фільтр з активованим вугіллям) в будинок.
В результаті вода не містить заліза і у неї набагато менше органічних речовин.
Для того, щоб видалення домішок було повнішим, просто збільшується час озонування. Порядок експерименту простий - налили воду в бак, пропустили озон 2 години, годину, 3 години, 4 години і порівняли внеший вид води.
Потрібно пам'ятати, що в забрудненій воді озон майже повністю розкладається і стає безпечним для людини за 20, а для вірності - за 30 хвилин. Тобто, пити воду можна тільки через цей час.
Вважаємо час: початок наповнення бака о першій годині ночі. Наповнення бака 2 години - 3 годині ночі. Час для деструкції озону в воді - 30 хвилин. 3.30 ночі - вода готова до використання.
Витрати на проект мінімальні, з змінних елементів - тільки картриджі механічного очищення вугільної фільтрації, які були присутні б при будь-якій схемі водопідготовки - і з озоном, і без озону. Інших змінних елементів і витратних матеріалів немає - ні заміни каталітичної завантаження, ні витрат на марганцівку або сіль.
Де беруть озонатори? В основному у тих компаній, які займаються басейнами. Вони ж підкажуть і покажуть, а, можливо і встановлять.
Таким чином, озонування при правильному підході - це комплексна очистка води.

За матеріалами http://voda.blox.ua/2008/10/Kak-vybrat-filtr-dlya-vody-34.html
При нормальних умовах озон - газоподібна безбарвна речовина, що володіє різким запахом. Вважається, що запах озону - це запах свіжого повітря після грози. Це дійсно так, але лише в тому випадку, якщо його концентрація дуже мала і становить частки гранично допустимих концентрацій (ГДК). Детальний опис фізико-хімічних властивостей озону розглядається в численних роботах, зокрема. деякі основні фізико-хімічні властивостіозону наведені в таблиці 1.1.
1.1. Основні фізико-хімічні властивості озону.
Розчинність озону в воді
При розчиненні озону в воді, його концентрація поступово підвищується і досягає граничних значень для даних условій.Растворімость озону в воді може бути виражена або у вигляді так званого коефіцієнта Бунзеа - β, що показує відношення обсягу розчиненого озону, приведеного до нормальних умов, до обсягу води ( Vоз / Vв), або в абсолютних значеннях розчиненого озону (г / л). При цьому вважається, що процес розчинення підкоряється закону Генрі, згідно з яким кількість розчиненого озону пропорційно тиску газоподібного озону над раствором.Етот закон може бути записаний у вигляді:
Cстац = β M · Pγ, г / л
Де: Cстац - розчинність озону, г / л; β - коефіцієнт Бунзена; M - щільність озону = 2,14 г / л; Pγ - парціальний тиск озону в розглянутій газовому середовищі.
Слід зазначити, що розчинність озону набагато вище основних атмосферних газів - азоту і кисню, але слабкіше таких окислювачів, як хлор і двоокис хлора.Растворімость озону швидко підвищується з пониженням температури води.
Розкладання озону в воді
Одночасно з розчиненням озону в воді відбувається його розкладання. При цьому швидкість його розпаду, як і зворотна величина «час життя», залежить від температури води і, в основному, від складу води-в першу чергу від наявності у воді різних домішок, особливо деяких органічних сполук та іонів металів. Ці положення добре ілюструється даними, наведеними на малюнку 1.2. 
Малюнок 1.2. . Розкладання озону в різних видах води при температурі 20 ° С.
- Бидистиллят. 2. Дистиллят. 3. Вода «З-під крана». 4. Фільтрована вода Цюріховского озера.
Час життя в одноразово дистильованої воді 20 хвилин, а в звичайній воді кілька хвилин.
Реакція озону з неорганічними речовинами.
Озон може реагувати з різними, що знаходяться у воді речовинами за двома різними механізмами: безпосередньо як озон (в молекулярній формі) і вигляді радикала ОН *, який виникає при розпаді озону в воді. Вважається, що в нейтральній воді ці 2 канали реакцій розподілені порівну. У кислому середовищі переважає молекулярний механізм, а в лужному - радикальний. Оскільки озон виступає в хімічних реакціях як окислювач, то можна судити про його окислювальної здатності по, так званій, величиною окисного потенціалу. Значення величин окисних потенціалів різних речовин, що є окислювачами, наведені в таблиці 1.3.
окислювачі |
Окислювальний потенціал (Вольт) |
Відносить. Окслі. потенціал до ОК піт. хлор |
гідроксил радикал |
||
атомний кисень |
||
Перекис водню |
||
хлорнуватиста кислота |
||
діоксид хлору |
||
З таблиці 1.3. випливає, що озон є найсильнішим окислювачем. З стабільних речовин він поступається тільки фтору, різко перевершуючи хлор.Еффектівность реакції озону з деякими неорганічними речовинами можна оцінити за початковими швидкостями взаємодіє з ними озону (точніше за питомими швидкостям реакцій, так званим констант швидкостей або їх зворотним величинам - часів реакцій). Частково ці дані представлені на малюнку 1.3.
Реакція озону з металами
Іони заліза і марганцю швидко окислюються озоном до гідроксиду заліза і діоксиду марганцю. Перманганат також може бути утворений за такою реакції: 2Mn + ² + 5O3 + 3H2O □ 2MnO4ˉ + 3O2 + 6H + Паралельно з цим процесом відбувається інший процес - усунення марганцю з розчину:
2Mn + ² + 2O3 + 4H2O □ 2MnO (ОН) 2 ↓ + 2O2 + 4H + Окислення іонів оксиду марганцю, кобальту та нікелю відбувається зі швидкостями, які відповідають величинам констант швидкостей порядку 1 л / моль сек. Видалення цих металів відбувається в процесах флокуляції-фільтраціі.Хром може бути окислений до шестивалентного хрому. Процес цей складний, вимагає особливих умов. 5 6Свінец окислюється озоном PbO2 c константою швидкості реакції близько 10 -10 л / моль сек. Метали, що утворюють комплекси з EDTA, такі як Pb, Ni, Cd і Mn, спочатку проходять стадію руйнування комплексу, а потім окислюються. Такі реакції відтворюють умови комплексоутворення цих металів з природними гуміновими кислотами.
Реакція озону з органічними сполуками.
Електронна структура озону біполярного: з одного боку - негативна, з іншого - позитивна. З цієї причини озон може реагувати одночасно як електрофільного так, і нуклеофільно.Обично в реакції прямого окислення речовин озоном в воді переважає електрофільні механізм.Кінетіка споживання розчиненого озону різними органічними сполуками була вивчена Hoigne і С.Д. Розумовським. Частково ці дані наведені на малюнку .Дать характеристику реакції всіх основних органічних речовин з озоном досить важко. Розглядаючи прямий вплив озону, можна відзначити деякі загальні положення: Насичені алкільні сполуки реагують з озоном дуже повільно. Більшість хлорованих вуглеводнів і навіть, ненасичені вуглеводні не реагують безпосередньо з озоном. В цьому випадку необхідно опосередковану взаємодію з озоном через радикал ОН. Бензол окислюється озоном дуже повільно, а поліциклічні вуглеводні швидше.
Час реакції озону з фенольними сполуками становить наскільки секунд. Частково реакційна схема для фенолу представлена на малюнку 1.5. Іон фената реагує швидше, ніж протоновану фенол. Слід зазначити, що константи швидкості дуже великі і близькі для фенолів різної будови. Карбоксильні кислоти, кетова кислоти і ряд подібних з'єднань є кінцеві стабільні продукти процесу окислення органічних речовин озоном. Аміни при нейтральних значеннях рН реагують досить повільно з озоном, при рН> 8 реакції окислення проходять швидше. Однак, в основному, реакції окислення амінів йдуть через ОН радикали. Четвертинні аміни (ароматичні аміни) реагують з озоном швидше. Спирти можуть взаємодіяти з озоном, утворюючи як проміжних сполук гідропероксид. При цьому вони окислюються до карбоксильних кислот, в той час як вторинні спирти - до кетонів. Карбонові кислоти з озоном реагують слабо або не реагують взагалі.
Меркаптани окислюються з озоном до сульфонових кислот. Бісульфітом і сульфоновиє з'єднання є проміжними речовинами. Амінокислоти, до складу яких входить сірка (цистеїн, цестін і метіонін), реагують швидко. Амінокислоти (складова частина білків) реагують по електрофільні механізму. Серед пестицидів, що містять ефіри фосфорної кислоти, найбільш відомим є паратіон. Озонування цього з'єднання призводить до появи параоксон, який більш токсичний, ніж паратіон. Подальше озонування перетворює параоксон в менш токсичні речовини (наприклад, в нитрофенол, який потім окислюється до кінцевих продуктів - нітратів і СО2).
При обробці питної води механізм прямого окислення через озон в молекулярній формі є основним. Константи швидкостей великого числа органічних сполук з озоном представлені в огляді Hoigne.
- Озон, як інактиватор мікрофлори.
Як уже згадувалося вище, озон має потужну бактерицидну і вірулентним (інактивує віруси) действіем.В науковій літературі (особливо популярною) часто стверджується, що озон дійсно дезактивує бактерії і віруси сильніше, ніж хлор (і це буде проілюстровано нижче), але до якісним оцінкамицієї переваги треба ставитися з певними оговоркамі.Еффектівность різних дезінфектантів добре ілюструється даними малюнка 2.1.

Малюнок 2.1. Швидкість дезактивації патогенна Е-coli різними дезактивирующими агентами.
В даний час при оцінці ефективності того чи іншого дезинфектанта використовуються так звані З х Т критерій, тобто твір концентрації реагенту на час дії. Можна сказати, що ДІЯ (інактивації) = Концентрація Час воздействія.В таблиці 2.1. представлені для порівняння значення СГТ критерії для різних мікроорганізмів - дезінфікуючих агентов.Табліца 2.1. Значення СГТ критерію для різних мікроорганізмів (99% інактивації при 5-25 ° С. СГТ критерій (Мб / л хв))
вид мікроорганізмів |
Озон рН: 6/7 |
Вільний хлор рН: 6/7 |
Хлорамін рН: 8/9 |
Двоокис хлору рН: 6/7 |
поліовірусу |
||||
ротавіруси |
||||
Гардіалямблацісти |
||||
Гардіа мюрісцісти |
||||
Кріптоспорідіум |
||||
Для 90% інактивації (1 log) |
Очевидно, що озон перевершує такі дезінфектанти, як хлор, хлорамін і двоокис хлора.Для такого патогенна, як кишкова паличка (Е-coli), озон більш ефективний, ніж хлор, але не набагато. У той же час для кріптоспорідіума відношення С Т критеріїв цих дезінфекторів наближається до 1000. Передбачається, що в принципі озону можуть скласти конкуренцію такі дезінфікуючі реагенти, як хлор, бром, йод, двоокис хлору і серебро.Молекулярний газоподібний хлор, розчиняючись у воді, розпадається , виробляючи хлористую кислоту HOCl, яка, в свою чергу, дисоціює в воді на аніон СЕО і катіон Н. Ступінь цієї дисоціації визначається кислотністю середовища. Встановлено, що при рН = 8 концентрація недіссоцііроавшей кислоти ≈ 20%, а при рН = 7, концентрація НСlО≈80%. Так як сильну бактерицидну дію має саме НСlО, то при використанні хлору (навіть у вигляді гіпохлориту) необхідно підтримувати оптимальне значення рН.Йод, як дезінфектант, використовується для дезінтіфікаціі в невеликих системах водопідготовки і іноді в плавальних басейнах невеликого обсягу. За своїм дезінціфіцірующім властивостями йод слабкіше хлору і тим більше озону, але він більш зручний в транспортіровке.Бром, в принципі, може використовувати для цілей дезінціфікаціі, однак, в присутності інших окислювачів він утворює баласти, похідні кислоти HbrO3, які є вельми шкідливими і їм відповідає низьке значення ГДК. Ця проблема - утворення броматов при озонуванні бром містять вод-є досить серйозною і ми зупинимося на ній в розділі «Використанні озону для підготовки питної води» .Крім того, останнім часом вітчизняна та зарубіжна промисловість пропонує ряд органічних речовин, що володіють сильним дезинфікуючим дією. Однак всі вони мають ті чи інші недоліки і великого поширення до теперішнього часу не нашлі.- Довгий час використовувався рідкий хлор з балонів під тиском, що було великою проблемою з точки зору безпеки. В даний час хлор отримують в спеціальних апаратах-Хлорат, при електролізі розчину кухонної солі або використовують гіпохлорит, який, розчиняючись у воді, створює необхідну концентрацію вільного хлору. Треба відзначити, що під терміном «вільний хлор» розуміють концентрацію хлорнуватисту кислоти HСlO. Використання хлораторов викликає необхідність в зберіганні запасу реагенту, а гіпохлорит при зберіганні розкладається і зміст вільного хлору падает.Озон проводиться на місці і все що потрібно для його виробництва - це озонатор і електроенергія. - Хлор отруйний газ (ГДК для хлору становить 1 мг / м³). Він вперше був використаний як бойова отруйна засіб в першу світову війнуі жертви його були многочісленни.Озон теж відноситься до категорії токсичних газів і його ГДК досить низький (0.1 мг / м³). На щастя, озон володіє надзвичайно сильним характерним запахом і людина відчуває присутність озону в повітрі набагато раніше, ніж його концентрація досягне небезпечної величини (поріг нюху ≈ 0.1 / 0.5 ГДК). Необхідно підкреслити, що до теперішнього часу невідомо жодного смертельного або навіть важкого, що вимагає госпіталізації, випадки отруєння озоном. Питання токсичності озону буде розглянуто нижче отдельно.Одно з основних неприємних властивостей хлору полягає в тому, що при його реакції з більшістю органічних сполук виникає цілий спектр хлорорганічних похідних, більшість з яких сильно ядовіти.Хлорфеноли і полихлорфенолов, особливо, так звані діоксини, є одними з найсильніших відомих в даний брешемо органічних отрут, причому дія цих токсинів полягає в руйнуванні імунної системи людини. Так що, говорячи про діоксинах, іноді використовують термін «хімічний СНІД» .Хлор дуже легко взаємодіє з аміаком, утворюючи хлораміни. Ці речовини мають досить слабким дезинфікуючим дією, але надзвичайно сильно подразнюють слизові оболонки очей і носоглоткі.Хлораміни часто називають «пов'язаним хлором». Цей пов'язаний хлор в 5-10 разів сильніший подразник, ніж вільний хлор.Озон також може утворювати проміжні сполуки (by products) при озонування газових і конденсованих середовищ. Теоретічекі можна допустити, що утворюються by products більш токсичні, ніж озон.Ета проблема була предметом досліджень багатьох вчених усього світу. Концентрації і складу проміжних речовин, що виникають при озонування, дуже залежать від того, озонується чи питна або стічна вода. Безумовно, в першому випадку утворюється набагато менше by products і склад їх більш очевидний. Всі ці питання будуть розглянуті у відповідних розділах огляду. Можна резюмувати досить збігаються питання багаторічних досліджень наступним чином:
- У переважній більшості випадків проміжні продукти окислення забруднювачів озоном менш токсичні, ніж вихідні інгредієнти.
- Пряме порівняння проміжних речовин, що утворюються при порівняльних експериментах з хлорування і озонування, показало, що в першому випадку утворюється набагато більше by products.
2.1. Дезінфекції хлором і озоном на промислових очисних станціях і в лабораторних умовах.
Багаторічна історія використання цих 2-ох дезінфектантів на великих водоочисних станціях містить багатий фактичний матеріал, що дозволяє судити про їх переваги та недоліки. У згадуваній вже книзі «Озонування води» наводиться ряд цікавих прімеров.Так за час тривалої експлуатації станції в Ніцці в озонованою воді ніколи не були виявлені бактерії Escherichia coli і Clostridium pertringers.
На фільтрувальної станції Бельмонт в Філадельфії (США) озонування води дало більш успішні результати по відмирання e-coli, ніж результати, досягнуті при хлорірованіі.Ісследованія по озонуванню води проводилися на Східній водопровідної станції в м Москва. Ефект знезараження води озоном при утриманні загальної кількості бактерій в 1 мл 800-1200 од. становить: при дозі озону 1 мл / л - 60-65%, при дозі 2 мл / л - 85%, при дозі 3 мл / л - 90-95%. Прийнятною дозою озону слід вважати 3-4 мл / л.на Рублевской водопровідної станції (м.Москва) проводили озонування води річки Москви. Загальна кількість бактерій в 1 мл води після введення озону знижувалося на 92-99% в межах часу від 1-25 хв. Бактерицидна доза озону відповідала такої, після обробки, якої не можна було виявити e-coli в 500 мл. води. Підвищення каламутності з 6.8 до 12 мг / л і кольоровості з 3.2 до 18 Греден. вимагало збільшення бактерицидної дози озону з 3.2 до 4.1 мг / л.Станціі «Ріденор» і «Інголс» з США обробляли хлором і озоном суспензії e-coli в дистильованої воді при Нр = 6.8 і при температурі 1 ° С. У цих умовах бактерицидні дози, що викликають загибель 99% колоній e-coli, становили для хлору 0.25-0.3 мг / л за 16 хв, а для озону 0,5 мг / л за 1 мін.Однако хлор і озон впливають на бактерії не зовсім однаковим чином . З графіка 2.3. видно, що крива виживання бактерій падає з підвищенням дози хлору, причому, йде приблизно експонентний спад числа бактерій. При озонуванні спостерігається інша картина - при малих концентраціях озону його вплив на бактерії незначно, але починаючи з деякої критичної дози (0.3-0.5 мг / л) озон різко і повністю пригнічує мікрофлору, в на відміну від хлору, який залишає незначну їх частину неушкодженими. Згідно з деякими дослідженнями для бактерицидного дії озону необхідно певний час. При цьому озонується вся маса бактеріальних відсотків. Хлор виробляє вибіркове отруєння життєвих центрів бактерій, причому досить повільне через необхідність тривалого часу для дифузії в протоплазмі.
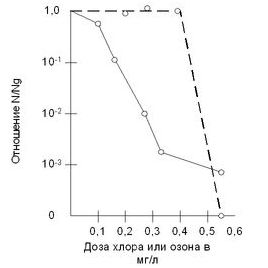
Графік виживання бактерій при обробці води озоном і хлором- - - - озон -------- хлор
2.4. Дія озону на суперечки, цисти і інші патогенні.
По відношенню до цієї мікрофлорі озон також виступає як ефективний бактеріальний агент. Зокрема по Брінгманну Bacillus subtilis знищувалися в воді озоном в 3000 разів швидше, ніж хлором. М. Кейн і Глекнер вивчали дію озону і хлору на цисти (щільні оболонки, що утворюються навколо одноклітинних організмів) Endamoeba hystolica і на бактерії, супутні цим культурам. Встановлено, що час, необхідний для знищення цих організмів при залишковій концентрації озону 0,3 мг / л, складає 2-7.5 хв, а для хлору (залишкова концентрація 0.5-1 мг / л) набагато більше - 15-20 хв.
Дія озону на віруси
Озон надає яскраво виражене, радикальний вплив на багато вірусів, що супроводжується повною гнучкістю вірусного протеїну. Вірусологи США і Німеччини в 40х-60х роках провели ряд досліджень з суспензиями вірусу поліоеміліта з метою його інактивації за допомогою хлору, озону і двоокису хлору. Висновки з цих досліджень можуть бути представлені в наступному вигляді:
- Інактивація вірусу поліоеміліта хлором досягається дозою 0,1 мг / л при температурі води 18 ° С, при температурі води 7 ºС доза хлору повинна бути не менше 0,25 мг / л.
- Інактивація вірусу за допомогою озону досягається дозою 0,1 мг / л при температурі води 18 ° С, для холодної води -7ºС доза повинна бути підвищена до 0.15 мг / л.
- При використанні двоокису хлору необхідно використовувати дозу 0.6 мг / л (18 ºС). Для води з температурою 7 ºС доза двоокису хлору повинна складати 1 мг / л.
За даними Науманна збудники поліоеміліта знищуються озоном за 2 хв при концентрації 0.45 мг / л, тоді як під час хлорування дозою 1 мг / л для цього потрібно 3 години.
Озон і гідробіонти
На думку ряду авторів озон успішно усуває мікроводорості і найпростіші, активніше, ніж хлор. Так озон при концентрації 15 мг / л за 3 хв руйнує види найпростіших, які зберігають свою активність при обробці води дозою хлору 250 мг / лв протягом тривалого часу. Личинки молюска дрейсени при дозі озону 0.9-1.0 мг / л загинули на 90%, при дозі 2 мг / л - 98%, при дозі 3 мг / л - повністю. Дорослі форми молюска гинули при більш тривалій обробці озонованою водою (до 30 хв). Правда, квітучі водорості, зазвичай бурхливо розмножуються у відкритих басейнах на сонячному світлі, слабо схильні до дії озону. Тут використовують ударні дози хлору. Цю обробку проводять зазвичай вночі при профілактичної чищення таких бассейнов.Подводя деякі підсумки гранично короткому порівнянні озону, хлору і двоокису хлору, як агента для очищення і знезараження води, відзначимо, що в певному сенсі цей спір було вирішено самим життям. Дійсно, досвід роботи водоочисних станцій, що використовують озон і хлор, повністю свідчить на користь озону. Так зіставляючи роботу французької станції водопідготовки в Сен-Мор і станції в Чикаго (США) В. Ф. Кожинов зазначає, що в першому випадку хвороби «водного походження» були зареєстровані лише в 1 випадку на 100 тис. Жителів, хоча концентрація залишкового озону в воді не перевищувала 0.05 мг / л. У той же час в Чикаго мали місце спалахи шлунково-кишкових захворювань, незважаючи на далеко не останнє вміст хлору у водопровідній воде.Одін з найбільших гігієністів минулого століття М. Т. Б. Уайтсон висловив на міжнародному конгресі з водопостачання в Стокгольмі (липень 1964 р ) таку думку: «Найбільш істотним запереченням проти озонування зазвичай вважають відсутність залишкового озону в розводящої водопровідної мережі, тоді як під час хлорування в мережі може бути виявлений залишковий хлор». Експерименти, проведені в м Аштон (Англія) показали, що в обеззараженной озоном воді, що циркулює в справної водопровідної мережі трубопроводів, не відбувається погіршення її якості. Контрольні проби озонованою води, взяті з мережі, виявилися абсолютно рівноцінними пробам, узятим з інших джерел, що містять залишковий хлор в воде.Установлено також, що невелика кількість залишкового хлору, наявне в трубопроводах не може надати жодного обеззараживающего дії на забруднення, викликані пошкодженнями комунікацій. Тобто присутність залишкового хлору в трубопроводах ще не означає неодмінної бактеріальної чистоти води, хоча, найчастіше, її вважають саме такий. Один з авторів цього огляду обговорював цю проблему з провідними працівниками цюріховского водопроводу і вони підтвердили думку М. Т. Б. Уайтсона, що при використанні чистих труб у водопровідних мережах повторного зараження озонованою води не проісходіт.Даже з цього короткого зіставлення озону з іншими окіслітелямі- дезинфектантами переваги озону бесспорни.Із стислості огляду ми не зупиняємося тут на таких позитивних властивостях озону, як посилення процесів коагуляції-флоккуляции, ефективне проведення процесу мікрофлоккуляціі, незрівнянно вищу якість води в плавальних басейнах, що використовують озон замість хлору і ряд інших. Нарешті, проблема вартості. Існує думка, що озонування значно дорожче хлорування. Однак це не так. В процесі хлорування виникає необхідність усунути зайвий хлор з води, провести так зване дехлорирование. Для отримання води задовільної якості це доводиться робити, застосовуючи спеціальні реагенти. З урахуванням цього фактора, а також тенденцій безперервного зниження ціни на озонаторне обладнання і підвищення ціни на хлор і хлор продукти, в даний час вартість цих процесів майже сопоставіма.Тем не менше, хлорування, якщо говорити про нашу країну, використовується частіше, ніж озонування . Чому? Є кілька причин: - психологічна причина. Працювати з хлором, особливо якщо мова йде про балони з рідким хлором, порівняно просто. Досить відвернути вентелі балона або вилити в басейн відро гіпохлориту, як всі проблеми з дезінціфікаціей вирішені. Це, безумовно, простіше, ніж стежити за концентрацією озону, що виходить з озонатора, враховуючи, що озонатор порівняно складний апарат і треба бути впевненим, що він несподівано НЕ отключітся.- Ось тут і виникає друга (а може бути і перша) причина слабкої поширеності озону. До самого останнього часу надійність озонаторного обладнання залишала бажати кращого, а низький рівеньавтоматизації припускав необхідність використання обслуговуючого персоналу щодо високої кваліфікаціі.Существенний прорив у проблемі створення надійного, нескладного в використанні озонаторного і озоноізмерітельного обладнання стало можливим після появи сучасних IGBT транзисторів, що дозволили різко спростити і здешевити виробництво імпульсних високовольтних генераторів, розвиток мікропроцесорної техніки і нових типів ультрафіолетових сенсорів , сучасних синтетичних цеолітів та ін. Все це, а також отримані результати досліджень імпульсних електричних розрядів в повітрі, дозволило розробити нові технологічні рішення, Що відкрили зовсім нові можливості для виробництва озонаторів неосушеного повітря, кисневих озонаторів, систем контролю залишкового озону в воді, озонометра, концентраторів киснюта іншого обладнання, що робить застосування озонування набагато більш простим і зручним технологією, ніж вона була раніше. Ми раді, що наші дослідження і розробки, захищені патентами в Росії, США, Японії та інших країнах допомагають робити життя людей більш простий, безпечної і, будемо сподіватися, довшою.
Список літератури
Драгінскій В.Л., Алексєєва Л.П., Самойлович В.Г. «Озонування в процесах очищення води» М. Делі принт. 2007 р
Інж. В.В. Караффа-Корбутть «Озон' і його застосування Вь промисловості і санітарiі» Изд. «Освіта» СПП. 1912 р
В.Ф. Кожинов, І.В. Кожинов «Озонування води» М. Стройиздат 1973 р
В.В. Лукін, М.П. Попович, С.Н. Ткаченко «Фізична хімія озону» Изд. МГУ 1998р.
Manley Т.С., Negowski S.J. «Ozone» in Encyclopedic of chemical Technology. Second Ed. Vol 14. N.J. +1967.
Hozvath M.H., Bilitrki, haud., Huttez. «Ozone» Ed. Akademie. Kiado. Budapest тисячі дев'ятсот вісімдесят сім
Коган Б.Ф. і бр. «Довідник по розчинності» т.1, кн. 1, М. тисяча дев'ятсот шістьдесят одна.
Masschelein W.J. «Processes unitaixes du treatmeut de l esu potable» Ed. CEBEIOC. Hiege. 1996.
Jore M., hegube B.J. Er. Hydrol. 14.11.1983.
Cowen W.Fetal. «Chemistry in water reuse». Ed. Ann. Azboz. Science Publ. Michigan. 1985.
Curol M.D. Env. Prog. 4.46.1985.
Hoigne J. «In Progress Technologies for water treatment» Ed. Plenum. Press №3. +1988
Розумовський С.Д. і Заїка Г.З. «Озон і його реакції з органічними сполуками» М. 1974.
Hubner R. Gesundheitstechnik №12. 1 973.
Dojbido J. Etol. «Освіта проміжних речовин в процесі озонування і хлорування» Wat. Res. 1999. 33. №4 р3111 - 3118.
Ridenour G.M., Inglols R.S. «American Jounal of Public Health» 1946. 3.6p 639.
Gomella C. 2e treitment d eux par l ozone. «Extract du mensuel» du ceutre Belge 287. 1 967.
Кожинов В.Ф. Озонування води. «Міське господарство Москви» 1970. №7.
Steinhardt. Stadtehygiene. 1S. 1956.
Naumman E. «Das gas nnd Wassertach» 1952. NY.p.81.
Dickerman J.M. etral. Journ of New England Water Works Ass. 1.11.1954.
Шалашова Е.С. «Прімненіе озону для очищення води жив-ком господарства» №6. 1960.
Thorp C.E Jnd Med and Surg. 1950. v19 p 49
М.У. 2.1.2.694-98. «Використання ультрафіалетового вимірі при знезараженні води плавальних басейнів».
Г.І. Рогожкін. «Очищення і знезараження води в басейнах» Сантехніка. 4.2003. стор 4-9.
